ORIGINAL ARTICLE
Assessment of the Susceptibility of Chlorhexidine to Specific Microorganisms
1Department of Dental Hygiene, Hanseo University, Seosan 31962, Korea
2Department of Oral Anatomy, Dental College, Dankook University, Cheonan 31116, Korea
Abstract
Objectives: This study aimed to identify the range of susceptibility of E. coli, S. enterica, P. aeruginosa, and S. aureus to chlorhexidine. Methods: First, an antibacterial evaluation was conducted using the zone of inhibition by disc diffusion method. For the statistical analyses, Shapiro-Wilk was used to verify normality, Kruskal-Wallis’ H analysis was performed for comparison between groups, and Bonferroni was carried out as a post-hoc analysis. Results: The zone of inhibition for each concentration of chlorhexidine by disc diffusion was different for each strain at 2%, 1%, and 0.1% (p<0.05). The Minimal Inhibitory Concentration (MIC) of chlorhexidine were 0.003% for E. coli, 0.005% for S. enterica, 0.009% for P. aeruginosa, and 0.006% for S. aureus; the Minimal Bactericidal Concentration (MBC) was measured as 0.1% for E. coli, 0.1% for S. enterica, 0.2% for P. aeruginosa, and 0.1% for S. aureus. Conclusions: The results of this study confirmed that the disc diffusion, MIC, MBC, and sensitivity of chlorhexidine to specific microorganisms are different depending on the microorganism type. Therefore, in the hospital environment, frequently used disinfectants should be managed more frequently, and susceptibility evaluation should be monitored more regularly.
Keyword
Chlorhexidine, Disinfectant, Microbial sensitivity tests
1. 서론
Chlorhexidine (Chlorhexidine Gluconate)은 1950년대부터 효과적이고 안전한 소독제로 의료계에서 광범위하게 사용되어왔다(1). Chlorhexidine은 그람 양성 및 음성 세균 다수에 효과가 있고(2) 치과 영역에서도 자주 사용되는 대표적인 소독제이다. 그러나 최근 chlorhexidine이 외용소독제로 사용되면서 감염사례가 자주 발생하여 안전에 대한 문제가 제기된 바 있다(3, 4). 특히 메티실린 내성 황색포도상구균(Methicillin Resistant Staphylococcus aureus, MRSA)의 내성 발현에 대한 보고로(5) 모든 미생물에 유효하지 않아 원내 소독제로서의 주의가 필요하다. 그간 일부 소독제는 항생제 다제내성균(Multidrug-Resistant Organism, MDRO)에 대한 문제 해결의 대안으로 여겨왔지만(5) 최근 다수의 연구에서와 같이 소독제의 내성균 검출에 대한 생성기전 및 문제 제기 등의 검토가 제시되고 있다(3-6).
Chlorhexidine은 일찍부터 구강 내 프라그 억제효과(7, 8)와 치은연상치태를 조절하는 약제로 선택되어 왔으며(9), 국내에서는 2010년 이후 2% 농도로 오랫동안 사용되어왔고 이후 문헌 및 연구 등에 힘입어 현재 임상에서는 0.12%가 주로 사용되고 있다(10). 일반적으로 소독제는 미생물을 억제시키거나 사멸시킬 목적으로 피부나 조직에 사용하며(11), 원내 수용액으로 사용 시 수술 전 피부 소독 및 손 씻기에 2 ~ 4%가 사용되며, 가글용, 치석방지, 구내감염의 치료로 0.12 ~ 2%가 사용되고, 시술자의 손이나 피부의 소독, 수술 부위, 의료기구 소독에는 0.1 ~ 0.5%, 상처, 화상, 피부 창상 부위에 직접 사용하는 경우는 0.05%가 주로 사용되고 깨끗한 기구의 소독에는 0.05%에 30분 이상 담그거나 0.5%에 2분간 담그어 사용한다(10, 12). 소독제의 농도가 높으면 미생물의 살균효과는 높일 수 있으나, 지속적인 높은 농도의 사용은 감염이나 내성 등 건강상의 문제를 야기할 수 있다(5). 또한 너무 낮은 농도의 소독제를 지속적으로 사용할 경우 세균들의 적응성을 높일 수 있어 소독제의 활성 및 내성 발생의 문제가 발생할 수 있다. 일부 낮은 농도에서 지속적으로 사용된 소독제의 감염 사례(3)나 기성품 외용소독제의 감염으로 인한 병원감염 사례(4) 등 임상에서 위험한 상황들에 노출되는 경우도 많다. 그러나 원내 환경을 고려할 때 검토된 연구는 부족한 상황이다. 특히, chlorhexidine은 치과에서 다빈도 사용되는 살균소독제로 임상에서 사용 농도를 고려한 평가 및 검사는 거의 이루어지고 있지 않다. 그간 대한민국약전 일반시험법의 미생물한도시험법 제3조 미생물한도시험의 기준에서도 “④ 이비인후과용제, 치과구강용액, 비뇨생식기관용삽입제 및 세정제. 다만, 소독제는 제외한다.”에 대한 규정을 근거로(13) 원내 외용소독제에 대한 관리는 미흡한 상황이었다. 그러나 최근 chlorhexidine이 일반의약품으로 분류 기준이 변경(2020. 05. 29)되면서 의약품 등의 미생물한도기준 및 시험방법 한도 기준을 준수하게 되어 안정성이 강화될 것으로 생각된다.
그럼에도 불구하고 외용제로서의 chlorhexidine의 감수성에 대한 문헌적 고찰은 제한적이다. 그리하여 본 연구에서는 chlorhexidine의 원내 사용 희석 농도를 고려한 최소억제농도(Minimal Inhibitory Concentration, MIC)와 최소살균농도(Minimal Bactericidal Concentration, MBC)를 확인하여 chlorhexidine 수용액의 특정균에 대한 감수성 범위를 확인하고 유효성 있는 농도를 확인하고자 본 실험을 진행하였다.
2. 연구방법
2.1. 미생물 및 연구재료
본 연구에 사용된 균주는 원내에서 자주 발견되며 미생물한도시험의 소독제 적용 범위에 제시된 4종의 특정 미생물(13)이며 Escherichia coli (E. coli) KCTC 1043, Salmonella enterica (S.enterica) KCTC 2515, Pseudomonas aeruginosa (P. aeruginosa) KCTC 1750, Staphylococcus aureus (S. aureus) KCTC 1621이다. 이는 한국생명공학연구원 생물자원센터에서 분양받아 glycerol stock(균주 배양액 500 ㎕와 glycerol 500 ㎕)하여 –76℃ deep freezer에 보관하여 사용하였다. 4종의 균주에 대한 배지는 성장 유도를 위하여 BHI (Brain Heart Infusion; BD Difco. Ltd., New Jersey, USA) 액체배지를 사용하였고, 디스크 확산 실험을 위하여 한천 고체배지를 사용하였다.
본 실험을 위한 기구 및 배지의 멸균은 고압증기멸균기(AC-60, Hanyang Science Lab Co. Ltd., Seoul, Korea)를 사용하였고, 무균작업대(TAKOS-65, Vision Scientific Co. Ltd., Daejeon, Korea)와 항온기(HQ-DI 84, Coretech Korea Co. Ltd., Anyang, Korea), 초저온 냉동고(NF-300SF, Nihon Freezer Co. Ltd., Tokyo, Japan)를 사용하였다. 그리고 chlorhexidine(α-hexidine 5%, Firson Co. Ltd., Cheonan, Korea)은 제조사의 기준에 따라 엄격하게 희석하여 즉시 사용하였다.
2.2. 디스크 확산법을 이용한 미생물 항균 평가
사용 균주인 E. coli, S. enterica, P. aeruginosa, S. aureus의 활성 평가를 위하여 Clinical and Laboratory Standards Institute (CLSI) guideline(14)과 Block C와 Furman M(15), Park JC 등(16)의 연구를 참고하여 디스크 확산 항균 평가를 실시하였으며 chlorhexidine의 농도별 미생물 활성억제구역(Inhibition zone)을 확인하였다. 먼저, 활성화된 E. coli, S. enterica, P. aeruginosa, S. aureus는 성장배지인 BHI 액체배지에 희석시켜 1×106 CFU/㎖ 농도로 만들고, 한천 고체배지에 각각 100 ㎕씩 분주하여 삼각봉으로 도말하고 37℃에서 24시간 배양하였다. 디스크 활성억제구역 확인을 위해 멸균한 10㎜ paper disc를 준비하고 멸균 증류수(Nagative control)와 chlorhexidine을 2%, 1%, 0.1%, 0.01% 농도별로 20 ㎕씩 paper disc에 충분히 적셔 상온에서 5분간 자연 건조시키고 4종의 미생물이 배양된 한천 고체배지에 각각 올려 다시 37℃에서 24시간 배양하였다. 4종의 미생물 모두 각각 10 plate씩 3회 측정하여 디스크 주위 억제구역의 직경을 측정하였다.
2.3. 특정 미생물에 대한 최소억제농도(Minimal Inhibitory Concentration, MIC)와 최소살균농도(Minimal Bactericidal Concentration, MBC)
특정 미생물에 대한 chlorhexidine의 최소억제농도(Minimal Inhibitory Concentration, MIC) 확인을 위하여 CLSI guideline(14), Park JC 등(16), You MS 등(17)의 연구를 참고하여 부분적으로 변경 및 수정하여 적용하였다. 4종의 특정 미생물인 E. coli, S. enterica, P. aeruginosa, S. aureus는 1×106 CFU/㎖ 농도로 설정하고, 96 well round bottom microtitration plate에 100 ㎕씩 주입하고, 농도별로 단계 희석한 chlorhexidine을 100 ㎕씩 주입하여 총 용량을 200 ㎕로 각각 맞춘 후 37℃에서 24시간 배양 후 같은 조건에서 확인하였다. 본 연구에서 MIC 값은 배양액을 육안으로 관찰하여 혼탁도가 전혀 없는 수준으로 결정하였다. 최소살균농도(Minimal Bactericidal Concentration, MBC)는 미생물 성장이 억제된 MIC의 well plate에서 약 50 ㎕를 한천 고체배지에 도말하여 37℃에서 24시간 배양하였고 chlorhexidine의 농도를 높여 반복 배양하였으며 미생물 살균이 99.9% 이상이 되는 시점을 MBC로 판단하였다. MIC와 MBC 값은 각 단계별로 동일한 값이 3회 반복된 최초의 값을 기준으로 다음 단계로 농도를 조절하였고 반복하여 최종 결과값을 도출하였다.
2.4. 통계방법
실험 결과는 IBM SPSS 21.0 프로그램(IBM SPSS 21.0 ver, SPSS Inc, IL, Chicago, USA)을 이용하였으며 디스크 확산법에 의한 chlorhexidine의 미생물 항균 평가는 Shapiro-Wilk를 사용하여 정규성 검증을 하였고, 4종의 미생물 종류에 대한 농도 차이는 Kruskal-Wallis의 H를 사용하였다. 사후검증은 미생물 종류간의 차이를 보기 위해 Bonferroni’s method를 사용하였다. MIC와 MBC는 4종의 미생물에 대한 희석한 chlorhexidine 농도값으로 동일한 값이 3회 반복된 최초의 값을 기준으로 다음 단계로 농도를 조절하였으며 최종 MIC와 MBC 역시 3회 반복된 최초의 동일한 값으로 결정되었다.
2.5. 윤리적 고려
본 연구의 윤리적 고려는 생명윤리 및 안전에 관한 법률에 따라 개인정보를 수집·기록하지 않은 인체유래물 연구로 분리·가공된 연구재료를 사용하여 수행되었으며 OO대학교 기관생명윤리 위원회의 심의면제 승인을 받아 진행하였다(HS22-04-05).
3. 연구결과
3.1. 디스크 확산법에 의한 chlorhexidine 농도별 항균 평가
Chlorhexidine의 농도별 항균 효과를 평가하기위하여 디스크 확산법에 의한 미생물 성장억제구역을 측정하였다. 2%에서는 E. coli 12.61 ㎜, S. aureus 12.06 ㎜, P. aeruginosa 10.15 ㎜, S. enterica 10.79 ㎜ 순으로 컸고(p<0.01), 1%에서는 E. coli 10.87 ㎜, P. aeruginosa 10.15 ㎜, S. enterica 9.78 ㎜, S. aureus 8.98 ㎜ 순이었으며(p<0.01), 0.1%에서는 E. coli 9.13 ㎜, S. enterica 7.99 ㎜, P. aeruginosa 7.88 ㎜, S. aureus 7.63 ㎜ 순이었다(p<0.01). 0.01%에서는 E. coli 1.09 ㎜, S. enterica 0.86 ㎜, P. aeruginosa 0.92 ㎜, S. aureus 1.36 ㎜로 아주 작은 억제구역이 나타났고 통계적으로 유의한 차이는 아니었다(Table 1). 멸균 증류수에서는 육안으로 측정하기 어려운 상수 0 값으로 나타났다. 4종의 미생물 모두에서 chlorhexidine의 농도가 높을수록 억제구역의 크기도 넓게 나타나 항균 효과가 높게 확인되었다(Figure 1).
Table 1. Disc inhibition zone by chlorhexidine concentration
|
D |
Microorganisms |
Zone of inhibition(㎜) |
χ2 |
p* |
|
|
Mean |
SD |
||||
|
2% |
E. coli(a) |
12.61a |
0.402 |
94.551 |
.001* |
|
S. enterica(b) |
12.06b |
0.566 |
|||
|
P. aeruginosa(c) |
10.15b |
0.378 |
|||
|
S. aureus(d) |
10.79a |
0.539 |
|||
|
Subtotal |
11.40 |
1.089 |
|||
|
1% |
E. coli(a) |
10.87ac |
0.618 |
86.856 |
.001* |
|
S. enterica(b) |
9.78bc |
0.377 |
|||
|
P. aeruginosa(c) |
10.15c |
0.378 |
|||
|
S. aureus(d) |
8.98d |
0.338 |
|||
|
Subtotal |
9.95 |
0.813 |
|||
|
0.1% |
E. coli(a) |
9.13a |
0.390 |
71.122 |
.001* |
|
S. enterica(b) |
7.99b |
0.246 |
|||
|
P. aeruginosa(c) |
7.88b |
0.284 |
|||
|
S. aureus(d) |
7.63b |
1.473 |
|||
|
Subtotal |
8.16 |
0.968 |
|||
|
0.01% |
E. coli(a) |
1.09 |
0.726 |
5.733 |
.125 |
|
S. enterica(b) |
0.86 |
0.866 |
|||
|
P. aeruginosa(c) |
0.92 |
1.043 |
|||
|
S. aureus(d) |
1.36 |
2.683 |
|||
|
Subtotal |
1.06 |
1.539 |
|||
|
In this analysis, it was first confirmed whether the small number of samples showed normality, and the Shapiro-Wilk test was performed to verify that the normality was followed by showing a p-value of 0.05 or more. |
|||||
|
*p<0.01 by Kruskal-Wallis. The post-hoc test used the Bonferroni analysis to observe the mean difference between groups. |
|||||
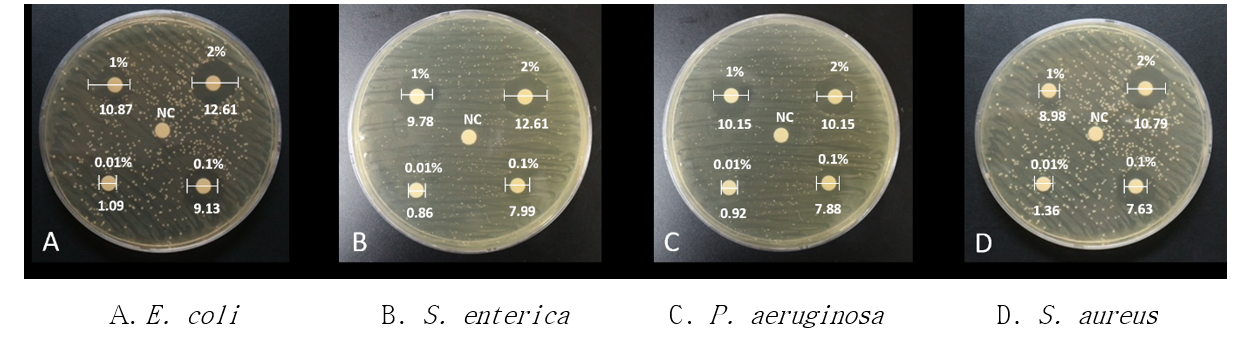
Fig. 1. Disc inhibition zone of chlorhexidine concentration by type of microorganisms.
3.2. Chlorhexidine의 MIC(Minimum Inhibitory Concentration)와 MBC(Minimum Bactericidal Concentration) 평가
E. coli, S. enterica, P. aeruginosa, S. aureus에 대한 MIC와 MBC 값은 다음과 같았다(Table 2). Chlorhexidine의 MIC는 Table 1에서 얻은 미생물 성장억제구역을 근거로 0.01% 농도에서 0.001% 농도까지의 범위에서 미세희석 및 배양하여 얻은 MIC 값은, E. coli의 경우 0.003%, S. enterica의 경우 0.005%, P. aeruginosa의 경우 0.009%, S. aureus의 경우는 0.006% 농도로 측정되었다. 즉, chlorhexidine의 MIC 값의 범위는 성장이 억제되는 일부 미생물만이 생존한 상태로 미생물 종류에 따라 차이가 있었고 0.003% 농도에서 0.009% 농도 사이였다. Chlorhexidine의 MBC 값은 MIC 값을 기준으로 한천 고체배지에 반복 배양하여 측정하여 99.9% 이상의 살균력을 나타낸 값으로 E. coli와 S. enterica, S. aureus는 0.1% 농도였고, P. aeruginosa는 0.2% 농도로 측정되었다(Table 2).
Table 2. MIC and MBC of chlorhexidine against 4 microorganisms
|
Microorganisms* |
MIC** |
MBC** |
|
E. coli |
≤0.003 |
≥0.1 |
|
S. enterica |
≤0.005 |
≥0.1 |
|
P. aeruginosa |
≤0.009 |
≥0.2 |
|
S. aureus* |
≤0.006 |
≥0.1 |
|
**Unit: 100㎍/㎖ |
||
|
**MIC and MBC for the chlorhexidine diluted concentrations (%) |
||
4. 고안
Chlorhexidine은 대표적인 원내 살균소독제로 미생물의 종류 및 사용 방법에 따라 성장 억제 및 살균 활성 작용에 차이가 있을 수 있으며(12) 본 연구에서도 미생물 종류별로 동일한 농도 2%, 1%, 0.1% chlorhexidine에서 생존억제구역의 차이가 유의하게 나타났다(p<0.05). 항균력은 미생물의 특성에 따라 즉, 세포벽과 세포막의 조성, 균의 성장상태, 점액 분비 여부, 콜로니와 생물막의 형성, 초기 세균 농도 등 다양한 영향 요소에 의해 차이가 날 수 있다(5, 18).
본 연구에서 선택한 4종의 특정 미생물에 대해 chlorhexidine의 MIC와 MBC 값을 확인했고 최종적인 chlorhexidine의 MIC는 E. coli 0.003%, S. enterica 0.005%, P. aeruginosa 0.009%, S. aureus 0.006% 농도로 나타났다. Choi HJ 등(10)의 연구에서는 치주병 원인균에 대한 chlorhexidine의 MIC는 0.0012% 농도보다 높은 것으로 보고하였고, Emilson CG(19)은 E. coli와 S. aureus 등에서 광범위한 낮은 MIC값을 보고하였으며 P. aeruginosa는 덜 민감한 것으로 보고하여 본인의 연구 결과와 유사하였다. 즉, 본인의 연구에서는 E. coli는 0.003%로 실험군 중 높은 감수성을 보였으며, S. enterica는 0.005%, S. aureus는 0.006% 농도로 중간 정도의 감수성을 보였고, P. aeruginosa는 0.009%로 실험군 중 가장 높은 농도를 나타내 낮은 감수성을 보였다.
MBC값은 본 연구에서 E. coli 0.1%, S. enterica 0.1%, P. aeruginosa 0.2%, S. aureus 0.1% 농도로 나타났고, 또다른 연구에서는 chlorhexidine의 MBC는 F. meningsepticum와 Serratia marcescens에서 0.025%로써 다른 균주에 비해 높았고(20) 낮은 농도에서도 저항 범위가 크게 나타났다. 또 Emilson CG(19)은 Propionibacterium acnes와 Selenomonas ruminantium에서 가장 낮은 감수성을 보인 것으로 보고하여, chlorhexidine이 그람양성균에 효과에 우수하고 그람음성균에는 효과가 다소 떨어지며(21) 호기성 또는 통성 혐기성에서 비교적 높은 감수성을 보이는 근거를 일부 설명해 준다(19). Chlorhexidine의 다빈도 사용에 대한 내성 발현의 우려로 이전 연구에서는 chlorhexidine 메티실린 내성 황색포도상구균의 발현에 대해 유효하지 않은 감수성을 확인하였고(4) 이미 다른 연구에서도 chlorhexidine 내성 출현 가능성에 대한 우려가 제기되어와(15, 21) 주의가 필요하다. Block C와 Furman M(15)이 6주 동안 병원에서 분리하여 가장 많이 발견된 균주는 조건 혐기성 미생물, 그람 양성구균 S. aureus(60개), 응고효소 negative staphylococci(48개), Klebsiella pneumoniae(32개), P. aeruginosa(60개), Acinetobacter baumannii(16개)와 Candida albicans(35개) 등으로 발표하고 chlorhexidine의 사용 정도와 감수성은 통계적으로 유의미한 상관관계를 나타내는 것으로 보고하였다. 즉, 부적절한 지속적인 사용이 미생물 저항성을 높이거나 미생물 감수성을 낮출 수 있음을 주시하여 관찰하였다. 한편 Lamfon H 등(22)의 연구에서는 생물막 형태의 C. albicans가 물속에 떠다니는 형태의 동일한 균주에 비해 chlorhexidine의 저항성이 8배 더 크다고 보고했다. 즉, 조밀한 구조의 생물막은 항균제 및 소독제가 세포에 도달하는 것을 일부 막아 주는 효과를 나타낼 수 있다(23). Bonez PC 등(24) 역시 chlorhexidine은 검사한 미생물 중 대부분 우수한 항균 활성을 나타내었지만 A. baumannii, E. coli, Methicillin S. aureus, P. aeruginosa가 생물막 형태일 때 덜 효과적이었다고 보고하였다. 또 다른 Totè K 등(25)의 연구에서도 chlorhexidine이 형성된 생물막이 생존력을 84%감소시키는 결과를 확인하였다. Chlorhexidine이 구강 내 영역에서 플라그와 결합한 세균 부산물에 대해 치아에 흡수되는 것을 막아주는데 유용하게 사용되고는(22) 있으나 선행연구를 종합할 때 생물막을 형성하는 균주의 상태일 때 즉, 습기를 포함하는 구강 내 상태나 여러 병원 환경에서 chlorhexidine의 감수성은 낮아질 수 있어 주의가 필요하다. 이렇게 chlorhexidine이 막을 구성하는 세균의 벽에 도달할 수 없고 정전기적 상호작용에 의한 세포막 흡착으로 생물막 형태의 미생물에 쉽게 작용할 수 없는 기전으로 해석될 때(24) 제한점에 대한 고려가 필요하다.
Addy M과 Wright R(26)의 연구에서는 0.2% chlorhexidine과 1% povidone iodine의 항균 특성 비교에서 0.2% chlorhexidine이 1% povidone iodine보다 MIC가 낮은 농도에서 항균 효가가 더 높게 나타났고, 또 Lim HS 등(27)의 연구에서는 0.2% chlorhexidine보다 10% povidone iodine이 항균 효가가 더 높게 확인되었고, 적용 시간과 물리적 세척을 시행한 결과 0.2% chlorhexidine과 10% povidone iodine 모두가 적용시간이 길수록, 물리적 세척을 시행한 경우에 효과가 더 증가되는 것으로 보고하였다. 또 Addy M과 Wright R(26)의 연구에서는 세척제로서 1% povidone iodine은 헹구고 2분간의 즉각적인 항균 효과만 발휘하는데 비해 0.2% chlorhexidine은 3시간까지 타액 표본이 유지되었음을 관찰하였다. 이에 0.2% chlorhexidine은 1% povidone iodine에 비해 구강 내 항균 수준의 유지가 더 길게 이루어짐을 확인하였다. 그러나 chlorhexidine의 내성 발생 사례에 대해 일찍부터 보고되어왔고 rizarry L 등(28)은 cetylpyridinium chloride and chlorhexidine에 대한 메티실린 내성 황색포도상구균의 감수성에 대해 S. aureus균주에서 메티실린 내성 균주(methicillin-resistant)가 메치실린 민감성 균주(methicillin-sensitive strains)보다 민감도가 5~10배 더 컸다고 보고하여 소독제의 다중 메티실린 내성 황색포도상구균의 내성 출현을 예고했다. 최근, Ko SH 등(4)의 연구에서와같이 피부소독제로 사용된 0.5%chlorhexidineⓇ 기성 제품의 오염으로 유래된 Burkholderia cepacia 가성균혈증의 반복 유행에 대해서도 해당 제품의 사용을 중지하고 꼭 필요한 경우 원내 제조하여 사용하거나 10% povidone-iodine으로 중재함으로서 유행을 종식하였음을 보고한 바 있다. 미국 CDC (Centers for Disease Control and Prevention) infection control “The Regulatory Framework for Disinfectants and Sterilants”에서는(29) 환경 표면에 사용되는 소독제 및 살균제는 EPA (Environmental Protection Agency)가 규제하며 또한 의료 기기에 사용되는 위험한 또는 중간 정도의 위험한 소독제 및 살균제는 생체 조직에 사용되는 항균제로 간주하고 FDA (Food and Drug Administration)가 보다 철저하게 규제하고 있다. 제조업체는 FDA의 허가를 위해 권장 사항에 따라 제출하고 승인을 받아야만 제품으로 판매가 가능하다. 본 연구 결과에서 chlorhexidine의 MIC값의 범위는 0.003%에서 0.009% 사이로 나타났고, MBC값은 0.1%에서 0.2% 농도 수준으로 나타났다. Kim JH 등(20)의 의약품규격 및 품질평가 “의약품 중 살균소독제 오염 미생물 관리방안 연구”에서는 표준균주 15종에 대한 소독제 chlorhexidine의 MIC값의 범위는 0.0006%에서 0.0025%로 나타났고, MBC값의 범위는 0.002%에서 0.025% 농도로 확인되었다. 제조환경에 대한 소독제 선별과 활성에 대한 정보가 연구자마다 다소 차이가 있을 수 있고 소독제의 종류와 농도, 미생물과의 접촉시간, 온도, pH 등에 따라서도 달라질 수 있다. 이 연구에서 chlorhexidine의 감수성을 평가하기위해 문헌을 참고하였고, 연구방법의 표준화를 위해 노력하였으나 엄격한 항균 평가 기준에는 미치지 못한 제한점이 있다. 또한 본 연구에서 사용된 균주는 원내에서 자주 발견되는 미생물(15, 19, 24) 및 일부 수인성 병원균(30)이었고 살균소독제에 대한 대한민국 약전의 미생물한도시험에 제시된 일부 균주였으며(13) 추후 구강 및 피부에 출현하는 미생물에 대한 추가적인 연구가 필요하다. 본 연구를 통해 원내 환경을 고려한 chlorhexidine의 항균 감수성 평가 감시체계와 원내 제조에 기인한 주기적인 평가의 필요성을 공유하고 예방할 수 있는 정보를 제공할 수 있는 계기가 될 수 있기를 기대한다.
5. 결론
본 연구는 chlorhexidine의 감수성 평가의 중요성과 필요성을 제시하기 위해 시행되었으며 미생물 종류별 chlorhexidine의 감수성 범위의 차이를 확인하여 다음과 같은 결과를 얻었다.
1. Chlorhexidine의 미생물 성장억제구역은 2%에서는 E. coli 12.61 ㎜, S. aureus 12.06 ㎜, P. aeruginosa 10.15 ㎜, S. enterica 10.79 ㎜ 순이었으며(p<0.01), 1%에서는 E. coli 10.87 ㎜, P. aeruginosa 10.15 ㎜, S. enterica 9.78 ㎜, S. aureus 8.98 ㎜ 순이었고(p<0.01), 0.1%에서는 E. coli 9.13 ㎜, S. enterica 7.99 ㎜, P. aeruginosa 7.88 ㎜, S. aureus 7.63 ㎜ 순으로 유의하게 감수성이 컸다(p<0.01).
2. Chlorhexidine의 MIC는 E. coli 0.003%, S. enterica 0.005%, P. aeruginosa 0.009%, S. aureus 0.006%농도로 측정되었고, MBC는 E. coli 0.1%, S. enterica 0.1%, P. aeruginosa 0.2%, S. aureus는 0.1%농도로 측정되었다.
이상의 결과에서 chlorhexidine농도가 높을수록 특정 미생물의 성장억제구역 범위는 크게 나타났으며 미생물 종류에 따라 chlorhexidine의 감수성에 차이가 있었다. 이 연구가 원내 환경을 고려한 감염 발생의 위험을 줄일 수 있는 예방적 방안 모색의 기초자료가 되기를 바란다.
Acknowledgement
본 연구는 2022년도 한서대학교 산학협력단의 재원으로 지원을 받아 수행되었으며 교내연구지원사업에 의하여 수행된 결과물입니다.
References
1. Schmalz G, Arenholt-Bindslev D, Biocompatibility of dental materials. Heidelberg:Springer ;2009: 350-352.
2. Langslet A, Olsen I, Lie SO, LØkken P. Chlorhexidine treatment of oral candidiasis in seriously diseased children. Acta Paediatr Scand 1974;63(6):809-811. 10.1111/j.1651-2227.1974.tb04868.x. 

3. FDA drug safety communication. FDA requests label changes and single-use packaging for some over-the-counter topical antiseptic products to decrease risk of infection. Clin Infect Dis 2014;58(3):i-ii.
4. Ko SH, An HS, Bang JH, Park SW. Recurrent Burkholderia cepacia Pseudo-bacteremia related to contaminated commercial product of 0.5% chlorhexidine solution. Korean J Nosocomial Infect Control 2017;22(1):1-8. 
5. Park C, Lee JY, Lee SY, Kim SH, Choi JH. Identification of survival mechanisms for disinfectants resistance and the resistant-related factors. Cheongju:Korea Centers for Disease Control and Prevention;2020:10.
6. Russell AD. Biocide use and antibiotic resistance: the relevance of laboratory findings to clinical and environmental situations. Lancet Infect Dis 2003;3(12):794-803. 10.1016/s1473-3099(03)00833-8. 

7. Löe H, Schiottn CR. The effect of mouth rinses and topical application of chlorhexidine on the development of dental plaque andgingivitis in man. J Periodontal Res 1970;5(2):79-83. 10.1111/j.1600-0765.1970.tb00696.x. 

8. Renton Harper P, Addy M, Moran J, Doherty FM, Newcombe RG. A comparison of chlorhexidine, cetylpyridinium chloride, triclosan, and C31G mouthrinse products for plaque inhibition. J Periodontol 1996;67(5):486-489. 10.1902/jop.1996.67.5.486. 

9 Ainamo J. Control of plaque by chemical agents. J Clin Periodontol 1977;4(5):23-35. 10.1111/j.1600-051X.1977.tb00049.x. 

10. Choi HJ, Ji S, Kook JK et al. The effect of chlorhexidine on the formation of bone nodules by periodontal ligament cells in vitro. J Korean Acad Periodontol 2006;36(2):375-383. 10.5051/jkape.2006.36.2.375. 
11. Centers for Disease Control and Prevention. Oral Health home. Infection Prevention & Control in Dental Settings.Glossary of terms for infection prevention and control in dental settings. [online] http://www.cdc.gov/oralhealth/infectioncontrol/glossary.htm. 2023.2.14.
12. Marc CS, Maria K, Suzanne RH. WHO model formulary 2008(PDF). Geneva:World Health Organization;2009:321-323.
13. National Institute of Food and Drug Safety Evaluation. Microbial Limit Test. Cheongju:Ministry of Food and Drug Safety;2019:41-46.
14. Melvin PW, Jean BP, Carey Ann B, Shelley C, Patricia SC, Christopher D 외 18인. M02 Performance standards for antimicrobial disk susceptibility tests. 13th edition. Wayne USA:Clinical and Laboratory Standards Institute;2018:17-40.
15. Block C, Furman M. Association between intensity of chlorhexidine use and micro-organisms of reduced susceptibility in a hospital environment. J Hosp Infect 2002;51(3):201-206. 10.1053/jhin.2002.1246. 

16. Park JC, Park HW, Lee SY. Enhancement of erythrosine photodynamic therapy against Streptococcus mutans by chlorhexidine. J Korean Acad Pediatr Dent 2013;40(4):241-246. 10.5933/JKAPD.2013.40.4.241. 
17. You MS, Lee SY, Ma DS. In vitro antimicrobial activity of different mouthwashes available in Korea. J Korean Acad Oral Health 2017;41(3):188-193. 10.11149/jkaoh.2017.41.3.188. 
18. Poole K. Mechanisms of bacterial biocide and antibiotic resistance. J Appl Microbiol 2002;92(1):55S-64S. 10.1046/j.1365-2672.92.5s1.8.x. 
19. Emilson CG. Susceptibility of various microorganisms to chlorhexidine. Scand J Dent Res 1977;85(4):255-265. 10.1111/j.1600-0722.1977.tb00561.x. 

20. Kim JH, Noh JY, Lee UY, Yun SJ. A study for management of contamination prevention of human use antiseptic product. Cheongju:Ministry of Food and Drug safety;2014:76-77.
21. Korea Centers for Disease Control and Prevention. Guideline for disinfection and sterilization in healthcare facilities. Cheongju:Korea Centers for Disease Control and Prevention;2014:41-42.
22. Lamfon H, Porter SR, Mc Cullough M, Pratten J. Susceptibility of Candida albicans biofilms grown in the constant depth film fermentor to chlorhexidine, miconazole and fluconazole: a longitudinal study. J Antimicrob Chemother 2004;53(2):383-385. 10.1093/jac/dkh071. 

23. HØiby N, Ciofu O, Johansen HK et al. The clinical impact of bacterial biofilms. Int J Oral Sci 2011;3(2):55-65. 10.4248/IJOS11026. 


24. Bonez PC, Dos Santos Alves CF, Dalmolin TV et al. Chlorhexidine activity against bacterial biofilms. Am J Infect Control 2013;41(12):119-122. 10.1016/j.ajic.2013.05.002. 

25. Totè K, Horemans T, Vanden Berghe D, Maes L, Cos P. Inhibitory effect of biocides on the viable masses and matrices of Staphylococcus aureus and Pseudomonas aeruginosa biofilms. Appl Environ Microbiol 2010;76(10):3135-3142. 10.1128/AEM.02095-09. 


26. Addy M, Wright R. Comparison of the in vivo and in vitro antibacterial properties of povidone iodine and chlorhexidine gluconate mouth rinses. J Clin Periodontol 1978;5(3):198-205. 10.1111/j.1600-051X.1978.tb02280.x. 

27. Lim HS, Kim JJ, Kim MJ, Kim HK. Salivary bacterial counts on application time of oral antiseptic agents and mechanical irrigation. J Maxillofac Plast Reconstr Surg 2013;35(3):155-160. 10.14402/jkamprs.2013.35.3.155. 
28. Irizarry L, Merlin T, Rupp J, Griffith J. Reduced susceptibility of methicillin-resistant Staphylococcus aureus to cetylpyridinium chloride and chlorhexidine. Chemotherapy 1996;42(4):248-252. 10.1159/000239451. 

29. Centers for Disease Control and Prevention. The regulatory framework for disinfectants and sterilants. [online] https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-about-rare-serious-allergic-reactions-skin-antiseptic 2023.4.27
30. Kim SH. Salmonella serovars from foodborne and waterborne diseases in korea, 1998-2007: Total isolates decreasing versus rare serovars emerging. J Korean Med Sci 2010 ;25(12):1693-1699. 10.3346/jkms.2010.25.12.1693. 


