1. 서론
음식물 삼킴은 생명체 기능 유지에 반드시 필요한 영양과 수분을 공급할 뿐만 아니라 음식물을 씹고 삼키는 행위 자체에서 오는 즐거움을 느끼게 하며, 그에 수반되는 사회활동을 통해 삶의 질에 긍정적인 영향을 미친다(1). 또한 음식을 먹는 것은 인간의 가장 기초적인 욕구이며, 각 나라의 문화 또는 개인의 정체성을 나타내는 수단이 될 수 있고 사람들과의 사회적 관계를 유지하게 만드는 매우 중요한 활동이라고 할 수 있다(2). 정상적인 삼킴을 통해 문제없이 음식물 섭취를 할 수 있는 사람들은 편하게 음식물을 삼킴으로써 적절한 영양상태를 유지하고 일상생활을 영위하는 활동에 별다른 어려움을 겪지 않지만 그렇지 못한 사람들은 먹는 즐거움이 사라져 먹는 행위를 기피하게 되고 사람 간의 관계와 소통에 문제가 생길 수 있으며 동시에 사회적 고립감을 느끼기도 한다(3).
연하곤란(Dysphagia)이란 입과 위장 사이에서 발생하는 삼킴에 어려움이 있는 것을 말한다. 연하곤란을 겪는 환자는 음식 섭취에 제한이 생기면서 영양상태가 불량해지고 폐렴과 같은 호흡기 합병증의 발생률도 높다는 연구 결과가 있다(1, 4). 이처럼 연하곤란은 삶의 질을 현저히 떨어뜨리고 사망률을 높이는 주요 원인이 된다. 연하곤란은 노인, 신경학적 질환이 있는 환자와 두경부 질환이 있는 환자에게 주로 나타나지만 그 외에도 다양한 질병들이 연하에 지장을 주기도 한다(4). 또한 건강보험심사평가원이 제공하는 보건의료빅데이터개방시스템(https://opendata.hira.or.kr)의 2021년도 다빈도질병통계 연령별 요양급여비용총액 비율에 따르면 연하곤란으로 진료받은 전체 연령 환자 중 60세 이상 노인 환자의 비율이 86.9%를 차지하고, 우리나라의 요양원 환자들을 대상으로 진행된 2013년 연구에 의하면 요양원 입소자 중 절반 이상이 연하곤란을 호소하고 있다(5). 한국은 2025년에 초고령 사회에 진입할 것으로 예상되고 있으며(6) 이에 따라 노화와 다양한 질병으로 인해 연하곤란을 겪는 환자는 더 많아질 것으로 예상된다.
평균 수명이 계속해서 증가하고 있는 현대 사회에서 삶의 질을 높이고 건강 수명을 연장시키기 위해서는 연하곤란의 치료가 반드시 필요하다. 현재 임상에서 연하곤란을 치료하기 위해 식이 변형, 약물 치료, 수술적 접근, 운동 및 자극 기법 등 다양한 치료 방법이 사용되고 있다(7). 하지만 이런 방법들은 연하곤란의 근본적인 치료법이 아니며 대부분 대증요법에 불과하다. 따라서 연하곤란을 극복하기 위해서는 연하 관련 근육들의 재생 연구가 필요하며 이를 위해 연하 관련 근육의 발생과정을 먼저 이해할 필요가 있다. 본 연구에서는 인간의 연하 근육을 대신하여 해부학 및 생리학적 측면에서 유사도가 높고 실험에서 다루기 용이한 설치류를 이용하여 연하 근육의 발생과정을 살펴보려고 한다. 설치류의 연하 관련 구조물 중 기도를 보호하는 밸브인 후두 구조물과 그 주위를 둘러싸고 있는 내후두근(Intrinsic laryngeal muscles)의 해부학적 이해와 발생과정을 확인함으로써 연하 근육의 재생을 위한 발생생물학적 이해를 얻고자 한다.
2. 본론
2.1. 인간의 정상 연하
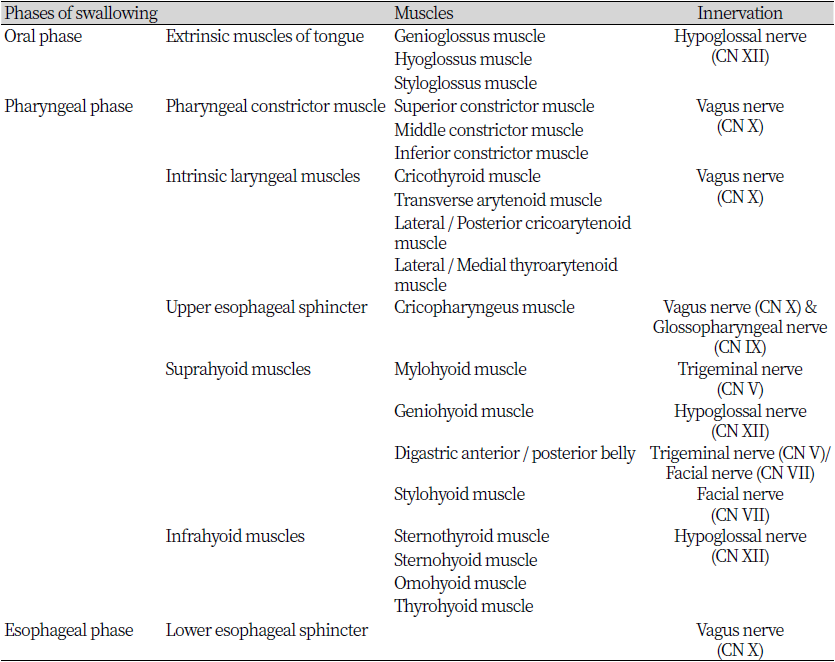
연하(Swallowing)란 30개 이상의 신경과 근육들의 의지적인 활동과 반사적인 활동들을 수반하는 복잡한 행동이며 음식물을 구강으로부터 인두를 거쳐 식도로 진행시키는 일련의 생리적 과정이다. 연하와 관련된 주요 근육을 지배하는 뇌신경으로는 삼차신경(V), 안면신경(VII), 설인신경(IX), 미주신경(X), 설하신경(XII)이 있다(4). 음식이 입안에서 인두를 거쳐 식도로 옮겨지는 정상적인 연하의 과정은 일반적으로 구강준비기, 구강기, 인두기, 식도기 4단계로 나눠진다(8). 구강준비기와 구강기의 동작은 수의적으로 진행되고 인두기와 식도기는 불수의적인 반사에 의해 진행된다(1). 음식이 입으로 들어온 순간부터 시작되는 구강준비기에서는 입 밖으로 흐르는 것을 방지하기 위해 입술을 다물게 된다. 턱과 혀의 움직임을 통해 음식을 치아에 위치시키고 저작하여 음식물을 잘게 찢고 부수어 침과 섞이게 한다. 이것이 음식덩이를 형성하는 과정이다. 구강기는 형성된 음식덩이를 인두 방향으로 보내는 과정이다. 혀는 앞에서 뒤로 이동하면서 음식덩이를 뒤쪽으로 이동시키고 혀의 중앙에 형성된 고랑을 따라 음식덩이가 인두로 향하도록 유도한다. 인두기에는 음식덩이가 인두로 운반되면서 삼킴반사가 시작되고 음식이 기도로 들어가지 않도록 하는 기도보호가 나타난다. 인두수축근(Pharyngeal constrictor muscle)에 의해 구개인두의 폐쇄가 일어나고 설골의 상승으로 후두 폐쇄가 일어난다. 이러한 후두의 움직임은 성대가 모아지면서 기도를 보호하는 것을 돕는다. 그리고 상부식도괄약근(Upper esophageal sphincter)의 윤상인두근(Cricopharyngeus muscle)이 이완되어 음식덩이가 식도 안으로 통과한다. 마지막 식도기는 자율신경계에 의해 조절되는 연동운동이 일어나는 곳이며, 음식덩이가 상부식도괄약근을 지나 위식도 경계로 도달하기까지의 단계이다. 식도에 도착한 음식덩이는 연동운동과 하부식도괄약근(Lower esophageal sphincter)을 통하여 위로 운반된다(9). 각 단계에서 문제가 생기면 구강기 연하곤란, 인두기 연하곤란, 식도기 연하곤란이 발생하고 이 중 구인두 연하곤란이 가장 흔히 나타난다(10).
정상 연하 단계 중 구강기, 인두기와 식도기에 관여하는 근육들을 정리하면 Table 1과 Figure 1과 같다. 구강기 근육 중 혀의 외재근(Extrinsic muscles of tongue)은 설하신경의 지배를 받아 혀를 움직여 음식덩이의 이동을 돕는다(11). 인두기 근육에는 미주신경의 지배를 받는 인두수축근과 내후두근이 있으며, 상부식도괄약근의 윤상인두근은 미주신경과 설인신경의 지배를 받는다. 설골을 기준으로 상부에 존재하는 설골상근(Suprahyoid muscles)의 종류로는 삼차신경의 지배를 받는 악설골근(Mylohyoid muscle), 설하신경의 지배를 받는 이설골근(Geniohyoid muscle), 삼차신경과 안면신경의 지배를 받는 악이복근(Digastric muscle)이 있으며 안면신경의 지배를 받는 경상설골근(Stylohyoid muscle)이 있다. 하부에 존재하는 설골하근(Infrahyoid muscles)은 모두 설하신경의 지배를 받으며 그 종류로는 흉골갑상근(Sternothyroid muscle), 흉골설골근(Sternohyoid muscle), 갑상설골근(Thyrohyoid muscle), 견갑설골근(Omohyoid muscle)이 존재한다(12). 마지막으로 식도기의 하부식도괄약근은 미주신경의 지배를 받는다(13)(Table 1).

Fig. 1. Muscles related to swallowing. (A-E) are shown in the oral(A), pharyngeal(B-D), and esophageal(E) phases. AC: Aritenoid cartilages, CC: Cricoid cartilage, CT: Cricothyroid muscles, DM: Digastric muscles, E: Esophagus, GG: Genioglossus muscle, GM: Geniohyoid muscle, H: Hyoid bone, HG: Hyoglossus muscle, ICM: Inferior constrictor muscle, LCA: Lateral cricoarytenoid muscles, LES: Lower esophageal sphincter, LTA: Lateral thyroarytenoid muscles, MCM: Middle constrictor muscle, MM: Mylohyoid muscle, MTA: Medial thyroarytenoid muscles, OHM: Omohyoid muscle, PCA: posterior cricoarytenoid muscles, SC: Scapula, SCM: Superior constrictor muscle, SG: Styloglossus muscle, SHM: Sternohyoid muscle, SM: Stylohyoid muscle, ST: Sternum, STM: Sternothyroid muscle, T: Tongue, TA: Transverse arytenoid muscle, TC: Thyroid cartilage, THM: Thyrohyoid muscle, UES: Upper esophageal sphincter.
2.2. 인간과 설치류의 연하 비교
설치류와 인간은 유전자 발현이 상당히 유사하며 해부학 및 생리학적 측면에서도 유사한 면이 많아서 인간의 질병에 대한 이해와 치료법을 검증하기 위해 실험 대상으로 사용되어 왔다(14-16). 먼저 인간은 출생 직후 혀를 이용한 빨기를 통해 영양을 섭취하고 구강 기능이 향상된 이후 음식을 씹고 삼키는 능력을 갖추게 되는데 이 패턴은 설치류에서도 마찬가지이다(17). 현재 밝혀진 해부학적 연구에서 발견된 유사점으로 두 종의 후두 구조는 인대와 막에 의해 연결되고 후두근에 의해 움직이는 후두연골(Laryngeal cartilages)로 구성되어 있다는 점이다. 후두연골이란 1쌍의 피열연골(Arytenoid cartilages: AC), 윤상연골(Cricoid cartilage: CC)과 갑상연골(Thyroid cartilage: TC)을 일컫는다(18). 후두연골과 근육 조직을 비교한 또 다른 연구에서는 두 종의 후두발달 과정이 유사하다는 점을 알 수 있다(19, 20). 그리고 해부·조직학적으로는 인간과 설치류 모두에서 구인두는 연구개의 끝부분과 후두개(Epiglottis)의 끝부분 사이에 있고, 후두인두는 후두개 끝부분에서 식도의 시작부분까지 이어져 있다는 공통점이 있다. 마우스 성체와 인간의 성대를 비교한 다른 연구에서는 성대 골격, 상피 및 근육 조직의 유사성이 있음을 발견했고, 성대가 형성되는 동안 발생하는 5가지 주요 사건들이 마우스와 인간에서 동일한 발달 단계를 거치는 것을 발견했다. 5가지 주요 발달 사건은 ①원시 후두인두와 함께 후두 및 성대(Vocal fold)의 발생 개시, ②상피판의 형성, ③상피판의 재개통과 성대의 분리, ④성대의 층화(stratification), 및 ⑤성대 상피의 성숙이 있다(21, 22). 마우스와 인간의 피열 연골을 비교한 연구에서는 두 종 모두 상피가 자유신경말단에 의해 신경지배를 받으며 미뢰의 밀도가 유사하다는 관점에서 생물학적으로 유사하다(22).
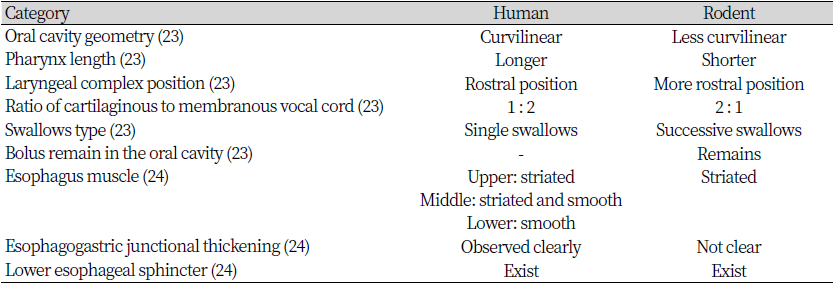
설치류와 인간의 연하 관련 해부학적 차이는 구강, 인두, 후두에서 볼 수 있다. Table 2와 같이 랫은 인간보다 길고 직선적인 구강을 가지고 있으며 더 짧은 인두를 가지고 있어 후두가 인간보다 주둥이 방향으로 위치한다(23). 인간은 후두 부위에서 관찰되는 연골과 막성성대(Membranous vocal cord)의 비율이 1 : 2인 반면 랫은 2 : 1로 구성되어 있다(23). 주둥이 쪽으로 위치되어 있는 후두의 위치와 연골 구성의 차이는 랫의 흡인을 감소시킬 수 있다. 또한 연하 후 구강에 잔류물이 없는 것이 일반적인 인간과 다르게 랫은 음식덩이 연속 삼키기를 수행하여 일부를 삼킨 후에도 음식덩이가 구강에 남아 있는 행동 패턴을 가진다(24). 또 다른 차이점으로는 형태학적 차이가 있다. 인간에서 인두에 가까운 식도벽 상부는 골격근인 가로무늬근, 중간부는 가로무늬근과 민무늬근이 섞여 있고 하부는 민무늬근으로 구성되며 점차적인 이행이 나타난다. 그러나 주머니쥐(Opossum)는 식도 전체가 가로무늬근이며 식도와 위의 경계부 주위에서 급히 민무늬근으로 교체가 나타난다(24). 식도와 위 경계부에서 인간은 비대칭적 근육 비후가 뚜렷하게 관찰되어 하부식도괄약근이 존재함을 확인할 수 있지만 주머니쥐에서는 근육의 비후가 관찰되지 않고 외형이 불규칙한 양상을 보인다. 이는 주머니쥐에서 하부식도괄약근이 형태학적으로 뚜렷하게 보이지는 않지만 존재하고 있음을 뜻한다(24)(Table 2).
2.3. 설치류의 내후두근의 조직발생학적 고찰
랫 내후두근의 발생과정을 보고한 선행 연구를 참고하여 연하의 인두기 단계에 관여하는 내후두근의 조직발생학적 특징을 확인하였다. 또한 본 연구에서는 마우스의 발생중인 내후두근의 3차원 재구성 이미지를 제시하여 입체적인 이해를 돕고자 한다. 이를 위해 임신 마우스로부터 발생 16일, 발생 18일 된 배아와 출생 후 0일, 출생 후 5일된 마우스를 획득하였다. 각 시기의 마우스를 4% 포름알데히드(Formaldehyde) 용액에 고정하고 파라핀(Paraffin)에 포매한 후 시료를 7 ㎛로 횡단면 절단하여 헤마톡실린 및 에오신(Hematoxylin and eosin) 염색을 하였다. 제작된 조직 절편을 현미경(DM 500, LEICA, Wetzlar, Germany)으로 관찰하고 카메라(ICC 50)로 이미지를 획득하였다(Figure 2B-E). 연속 절편에서 관찰되는 각 시기별 마우스의 근육, 기관 등을 Reconstruct 프로그램을 이용하여 3차원(Three-dimension)으로 재구성하였다(Figure 3).

Fig. 2. Histology of developing intrinsic laryngeal muscles in a mouse. (A) The horizontal section was made at the level of red line and is shown in B-E. (B-E) This area shows the developing epiglottic region of the larynx at E16 (E: Embryonic day), E18, PN0 (PN: Postnatal day) and PN5. All the sections were stained with hematoxylin and eosin, and were observed using a light microscope (magnification x 12.5). CC: Cricoid cartilage, CT:Cricothyroid muscles, E: Esophagus, LCA: Lateral cricoarytenoid muscles, LTA: Lateral thyroarytenoid muscles, *=MTA: Medial thyroarytenoid muscles, PCA: Posterior cricoarytenoid muscles. Scale bar represents 400 ㎛.

Fig. 3. Three-dimensional(3D) reconstructions of a mouse larynx at E16(E:Embryonic day), E18, PN0(PN:Postnatal day) and PN5. These show 3D reconstruction images of developing laryngeal muscles without (A-D) and with thyroid cartilage (E-H) at each stage in the superior view. (I-L) Reconstruction images in 3D of the developing laryngeal cartilages and the intrinsic laryngeal muscles at each stage in the posterior view are evident. (A, E, I) Primitive arytenoid cartilages (AC), cricoid cartilage (CC), thyroid cartilage (TC), lateral thyroarytenoid muscles (LTA), and posterior cricoarytenoid muscles (PCA) are observed at E16. (B, F, J) Cricothyroid (CT) and the medial thyroarytenoid muscles (MTA) are observed at E18. (C, G, K) More developed MTA, LTA, PCA, and lateral cricoarytenoid muscles (LCA) are observed at PN0. The CT appears to be larger than in the early stage. (D, H, L) Enlarged intrinsic laryngeal muscles and four laryngeal cartilages were observed at PN5. AC: Arytenoid cartilages, CC: Cricoid cartilage, CT: Cricothyroid muscles, LCA: Lateral cricoarytenoid muscles, LTA: Lateral thyroarytenoid muscles, MTA: Medial thyroarytenoid muscles, PCA: posterior cricoarytenoid muscles, TA: Transverse arytenoid muscle.
랫의 내후두근은 윤상갑상근(Cricothyroid muscles: CT), 외측갑상피열근(Lateral thyroarytenoid muscles: LTA), 내측갑상피열근(Medial thyroarytenoid muscles: MTA), 후윤상피열근(Posterior cricoarytenoid muscles: PCA), 외측윤상피열근(Lateral cricoarytenoid muscles: LCA), 횡피열근(Transverse arytenoid muscle: TA)으로 구성된다(20).
랫은 배아발생 11일(Embryonic day 11: E11) 이후 원시 후두 형성이 시작되고, 원시 후두의 양쪽에는 후두연골과 근육을 발생시키는 중배엽층이 있다. 랫 배아발생 11.5일째 상피세포의 응집으로 원시 후두인두의 형성을 위한 상피판이 형성되고, 네 번째 인두궁에서는 피열연골(AC)이 원추형 돌기 형태로 형성되기 시작한다(25).
랫 배아발생 13일에서 14일 사이 발달 중인 원시 윤상연골(CC)의 융합이 일어나고 피열연골(AC)의 발달도 계속 일어나는 동시에 V자 형태의 원시 갑상연골(TC)의 형성도 시작된다(25).
랫 배아발생 16일과 17일에서 후두개가 완성된다. 각 발생단계별 마우스의 갑상연골 아래뿔(Inferior horn) 부위를 횡단면 절단했을 때(Figure 2A), 발생 중인 내후두근과 후두연골의 단면을 볼 수 있다(Figure 2B-E). 발생 16일째 상피판의 세포들이 등쪽 측면으로 모여 피열연골(AC)을 완성한다. 내후두근 중 외측갑상피열근(LTA)은 원시 갑상연골(TC)의 안쪽에서 피열연골(AC) 쪽으로 뻗어 측면 표면에 붙어 있는 것이 관찰된다(20). 양쪽의 원시 후윤상피열근(PCA)은 원시 윤상연골(CC) 후방에 대칭으로 형성되어 각각의 피열연골(AC)까지 확장된다(Figure 2B). 보다 입체적인 이해를 위해 발생 16일째 발생된 근육들과 연골을 삼차원으로 재구성했을 때 위에서 보면 외측갑상피열근(LTA)은 윤상연골(CC)에서 갑상연골(TC)을 잇는 형태로 붙어있고(Figure 3A), 뒤에서 보면 후윤상피열근(PCA)은 윤상연골(CC)에 붙어 대칭으로 길게 이어진 것을 확인할 수 있다(Figure 3E, I).
랫 배아발생 18일에서 19일의 내측갑상피열근(MTA)은 피열연골(AC)의 중앙 앞쪽에 부착되고 성대 주름을 따라 확장되어 갑상연골(TC)의 중앙 부분에 부착된다(20). 윤상갑상근(CT)은 윤상연골(CC)에 측면에 붙어있는 형태로 관찰되고 외측윤상피열근(LCA)은 윤상연골(CC)로부터 확장되어 피열연골(AC)의 하방에서 관찰된다(Figure 2C). 이 시기의 내후두근과 후두연골을 삼차원으로 재구성하면 위에서 봤을 때 외측갑상피열근(LTA)의 안쪽으로 내측갑상피열근(MTA)이 관찰되고 윤상연골(CC)의 바깥쪽으로 윤상갑상근(CT)이 관찰된다(Figure 3B, F, J).
랫 배아발생 21일과 출생 후 0일에서는 보다 성숙한 내측갑상피열근(MTA), 외측갑상피열근(LTA), 후윤상피열근(PCA), 외측윤상피열근(LCA)이 관찰되어 뚜렷하게 나타난다(20). 육각형의 윤상연골(CC)의 측면은 윤상갑상근(CT)에 의해 덮여있고 후방은 후윤상피열근(PCA)에 의해 덮여있다(Figure 2D). 생후 0일에서 관찰되는 내후두근의 입체적인 해부학적 구조 파악을 위해 삼차원으로 재구성하면 윤상갑상근(CT)은 갑상연골(TC) 하방을 넘어 윤상연골활까지 확장되었고 그 외 근육들이 이전 시기보다 확장되어 붙어있는 것을 확인할 수 있다(Figure 3C, G, K).
생후 5일째에는 후두의 크기만 증가하였고 모든 근육이 더 두꺼워졌다(21). 크기가 확장된 생후 5일의 후윤상피열근(PCA)은 윤상연골(CC) 뒷면 전체를 덮고 있으며 윤상갑상근(CT)은 윤상연골(CC) 측면과 갑상연골(TC) 사이에 위치한다(Figure 2E). 이 시기의 근육들을 삼차원으로 재구성하면 위에서 봤을 때 윤상연골(CC) 가까이 붙은 외측윤상피열근(LCA)이 관찰되고 두꺼워진 다른 내후두근 또한 관찰된다(Figure 3D, H). 삼차원 구조물을 뒤에서 보면 크기가 확장된 후윤상피열근(PCA)과 피열연골(AC)의 뒷면을 넓게 덮고 있는 횡피열근(TA)을 확인할 수 있다(Figure 3L).
3. 결론
최근 노화로 인한 근육 소실과 근력 약화로 인해 연하곤란을 겪는 노인 환자가 늘어나고 있고 두경부암을 포함한 질병이나 불의의 사고로 연하 관련 근육의 일부를 상실하여 연하곤란을 겪는 환자가 증가하고 있지만 연하곤란을 근본적으로 치료하는 방법은 여전히 연구 중에 있다. 그렇기 때문에 연하곤란을 근본적으로 극복하기 위해서는 연하 관련 근육들의 발생과정을 이해해야 할 필요가 있다. 따라서 본 연구에서는 연하곤란 연구에 주로 이용되는 설치류의 연하가 인간의 연하와 어떤 유사점과 차이점을 가지는지 살펴보고, 설치류의 연하 관련 구조물 중 내후두근의 발생과정을 확인하였다. 두 종은 후두연골과 막성성대의 비율, 삼키기 유형, 근육의 종류 등 에서 차이가 존재하긴 하지만 해부·조직학적, 생물학적으로 유사한 후두 기관과 발생과정을 가지고 있다는 것을 알 수 있었다. 또한 선행 연구에서 흡인성 폐렴이 있는 쥐를 연구한 논문을 보면 연하 과정에서의 장애로 인해 폐렴이 발생하고(26), 동시에 연하 근육과 혀의 위축이 나타났는데 이는 흡인성 폐렴이 있는 인간 대상 연구에서도 동일하게 관찰되었다(27). 노화로 인한 혀의 후퇴 및 돌출 힘의 감소는 쥐와 인간 모두에서 나타나는 증상이며 연하에 상당한 영향을 미친다(26). 위와 같이 인간의 연하에 영향을 주는 요인들은 설치류의 연하에도 영향을 미친다는 연구들을 통해 인간과 설치류의 연하에는 상당한 부분이 유사하다는 점을 알 수 있다. 그 외에도 인간의 연하곤란의 원인을 특정 짓기 위해 안면 신경 손상 후 연하곤란이 초래된 마우스 모델을 만든 연구가 있고(28), 형질전환 마우스를 대상으로 연구하여 근위축성측색경화증, 일명 루게릭병을 앓고 있는 환자의 연하곤란은 주로 인두 단계의 삼킴 곤란 증상이라는 인간과 유사한 증상이 나타남을 밝힌 연구가 있다(29). 이처럼 설치류를 대상으로 진행된 연하곤란과 치료법 연구가 많아지고 있는 현 시점에서 본 연구에서 서술한 인간과 설치류의 비교는 앞으로의 설치류 연구에 기초자료로 참고될 수 있을 것이다.
랫과 마우스에서 배아발생 11일부터 생후 5일까지의 후두연골과 내후두근의 발생과정을 고찰하고 해부학적 구조를 파악함으로써 인간과 설치류의 내후두근은 대체적으로 유사한 구조를 가지고 있음을 확인할 수 있었다. 또한 발생단계별 내후두근의 발생과정에서는 후두연골이 먼저 발생하며 이후 외측갑상피열근(LTA), 후윤상피열근(PCA), 내측갑상피열근(MTA), 윤상갑상근(CT), 외측윤상피열근(LCA)과 횡피열근(TA) 순으로 발생한다는 점을 확인하였다. 그리고 내후두근의 입체적인 구조를 삼차원 재구성을 통해 확인하였다. 본 연구에서 파악한 설치류의 연하 관련 근육들의 해부학적 구조는 앞으로 필요한 발생생물학적 연구를 위한 기초 자료로 활용될 수 있을 것으로 사료된다. 또한 본 연구에서 내후두근의 발생과정은 확인할 수 있었으나 내후두근을 제외한 설골상근, 설골하근, 인두수축근 등 설치류의 다른 연하 근육에 대한 연구는 매우 부족하여 이들 구조물에 대한 추가적인 연구가 필요할 것으로 생각된다. 더 나아가 연하 근육의 발생학적 기원과 발생 동안의 신호전달체계에 대한 연구는 연하곤란 극복을 위한 근육의 기능적 재생에 대한 추가적인 이해를 도울 것이다.