1. 서론
최근 일부 치과 임상에서는 구강, 인두 점막의 자극을 완화하기 위한 대증요법으로 머금은 후 뱉는 2% 리도카인 가글액이 치과 공포와 통증 및 불안 경감을 위해 사용되기도 한다(1). 치과에서 리도카인은 주사법와 점막 도포 그리고 가글용으로 주로 사용되는데, 그중 리도카인 2%는 주사법과 가글용으로, 5%는 연고형으로, 10%는 스프레이형으로 많이 사용된다. 리도카인은 현재까지 개발된 국소마취제 중 가장 유용성이 크고 최소의 알레르기 반응을 보이며 비교적 심도가 깊은 국소마취를 유도하는 것으로 알려져 있다(2). 선행연구에서 스켈링 시 리도카인 2% 가글액을 이용하여 통증 경감 및 불안 해소에 유의한 효과가 있음을 보고하였고(1), 리도카인 5% 연고를 3분 이상 유지할 경우 치조점막에 통증을 경감시키는 효과가 있는 것으로 알려져 있다(3).
한편, 프로폴리스는 벌들에 의해 수집되는 수목류의 생장점을 보호하는 물질의 진액으로(4) 주요 약리작용은 항산화작용, 항균, 항바이러스, 항진균, 항종양 등 많은 선행연구에서 유의성이 확인되었다(5-7). 프로폴리스는 플라보노이드 성분인 caffeic acid phenethyl ester가 치아우식증의 원인균인 Streptococcus mutans(S. mutans)의 성장 억제와 Glucosyltransferase 활성 억제 효과가 인정된 바 있으며(8,9), 치아우식증 예방을 위한 농도에서 치은섬유모세포 및 치주인대 섬유모세포에 대한 세포독성을 보이지 않기 때문에 구강양치용액 개발에 이용될 수 있었으며(10), 프로폴리스를 이용한 구강 내 가글용액이나 스프레이, 치약 등의 다양한 상품이 실용화되어 사용되고 있다(4,10).
그리하여 본 연구에서는 구강 내 미생물 수를 낮추는 프로폴리스 용액을 치과 공포와 통증 및 불안 경감을 위해 사용되기도 하는 2% 리도카글액에 혼합하여 프로폴리스의 비율에 따른 항균 효과를 확인하고자 하였으며 구강 내 치아우식증 유발 세균인 S. mutans와 구강 내 상주균인 Streptococcus salivarius (S. salivarius), Streptococcus mitis (S. mitis)를 표준 세균으로 평가하여 프로폴리스를 혼합한 리도카글액 2%의 항균 효과를 확인하고 이를 통해 환자의 불편감을 낮출 수 있는 가능성을 모색하고자 하였다.
2. 연구대상 및 방법
2.1. 연구재료
본 조사는 프로폴리스(Water-soluble PropolisⓇ, yangbongnonghyup, Seoul, Korea)를 혼합한 리도카글액(Lidocagle solution 2%Ⓡ, Osstem, Seoul, Korea)의 항균효과를 알아보기 위해 실시되었다. 한국미생물보존센터(Korean Culture Center of Microorganisms; KCCM)로부터 분양받은 S. mutans (KCCM 40105), S. salivarius (KCCM 42736), S. mitis (KCCM 42896)를 표준 세균으로 하였다. 프로폴리스를 혼합한 리도카글액 2%를 10 vol%(프로폴리스 원액 100 ㎕, 리도카글액 900 ㎕), 20 vol%(프로폴리스 200 ㎕, 리도카글액 800 ㎕), 30 vol%(프로폴리스 300 ㎕, 리도카글액 700 ㎕)로 구분하여 실험 30초 전에 vortex mixer를 이용하여 표준세균과 혼합하였다. 대조군으로는 Negative Control (NC)에 증류수(Distilled waterⓇ, JW pharmaceutical, Seoul, Korea) 그리고 Positive Control (PC)에는 헥사메딘액 0.12% (Hexamedine Sol 0.12%Ⓡ, Bukwang Pharmaceutical Co., Ltd., Seoul, Korea)를 사용하였다.
2.2. 연구방법
2.2.1. 세균 저장 및 희석
실험 준비 단계에서 동결 건조된 S. mutans, S. salivarius, S. mitis의 활성화를 위해 각각의 균주는 BHI 액체배지(Brain Heart Infusion agar, BD Difco, New jersey, USA)에 접종한 후 Digital Incubator (HQ-DI 260, Coreteck, Anyang, Korea)에서 37℃, 24시간 배양하여 Glycerol stock으로 냉동 저장하였다. 이어 BHI액체배지 9 ㎖에 Glycerol stock으로 냉동 저장한 표준 세균을 해동하여 각각 1 ㎖씩 혼합하고 Digital Incubator 37℃에서 24시간 다시 배양하였다. 본 실험에서 모든 표준 세균은 S. mutans 3 x 106 colony forming unit (CFU)/mL, S. salivarius 5 x 105 CFU/mL, S. mitis 4 x 105 CFU/mL 농도로 희석하여 사용하였다.
2.2.2. 디스크확산법에 의한 평가
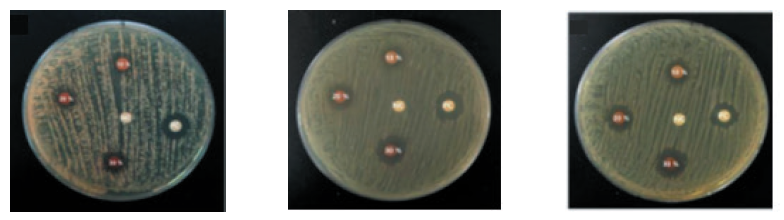
디스크확산법에 의한 항균 평가를 위해 일정 농도로 희석한 S. mutans, S. salivarius, S. mitis를 BHI agar plate에 100 ㎕ 접종 한 후 삼각봉으로 균일하게 spreading 도말하였다. 이어 프로폴리스 10 vol%, 20 vol%, 30 vol% 비율의 리도카글액, 증류수, 헥사메딘은 멸균된 Paper disc ∅6 mm (Paper disc, Advantec, Tokyo, Japan)에 각각 점적하여 10분간 건조시킨 후 세균이 도말된 BHI agar plate에 일정한 간격으로 압접하였다. 처리한 BHI agar plate는 37°C Digital Incubator에서 24시간 배양하고 버니어캘리퍼스로 inhibition zone의 지름을 측정하였으며 같은 조건에서 10개의 BHI agar plate를 1회의 실험으로 3회 반복 실험하였다.
2.2.3 균 활성도 평가
균 활성도 평가를 위해 준비된 농도의 S. mutans, S. salivarius, S. mitis를 96 well plate에 각각 100 ㎕씩 접종하고 프로폴리스 10 vol%, 20 vol%, 30 vol% 비율의 리도카글액, 증류수, 헥사메딘 0.12%를 각각 100 ㎕씩 추가하여 총량 200 ㎕를 Digital Incubator에서 37°C, 24시간 배양하여 분광광도계(Epoch™ Microplate Spectrophotometer, BioTek, Winooski, USA)로 관찰하였다. 700 nm에서 흡광도를 측정하였으며 그 값을 Optical Density (O.D.)로 하고 S. mutans, S. salivarius, S. mitis의 생존율을 각각 평가하였다. 이때 NC인 증류수의 O.D. 값을 100% 기준으로 설정하였으며 같은 조건하에서 5회 반복 실험하였다. 균 생존율(Viability rate)의 산출공식은 다음과 같다.
Viability rate (%) =  × 100 (%)
× 100 (%)
2.2.4. 균집락 형성평가
활성화된 각각의 S. mutans, S. salivarius, S. mitis 100 ㎕와 농도별로 희석한 0 vol%(증류수), 10 vol%, 20 vol%, 30 vol% 프로폴리스를 혼합한 리도카글액 100 ㎕를 1:1로 각각 혼합하여 그 중 100 ㎕를 BHI 고체배지에 접종한 후 삼각봉으로 균일하게 spreading 도말하고 37°C Digital incubator에서 24시간 배양하였다. 대조군을 기준으로 각각 10개의 BHI agar plate에서 형성된 균집락을 평가하였다.
2.3. 자료 분석
자료분석은 SPSS 21.0 ver. (SPSS Inc. Chicago, IL, USA) 프로그램을 이용하였으며 프로폴리스를 혼합한 리도카글액 2%의 S. mutans, S. salivarius, S. mitis에 대한 디스크확산법, 균활성도 평가, 균집락 형성평가를 위해 one-way ANOVA로 통계 분석을 하였으며 사후검정으로 Tukey test를 실시하였고 모든 분석은 95% 신뢰수준으로 분석하였다.
2.4. 윤리적 고려
프로폴리스를 혼합한 리도카글액의 항균효과를 평가하고자 실시한 본 연구는 인간생명윤리 및 안전에 관한 법률에 해당하지 않는 기관윤리위원회 심의 제외 대상 연구로 수행되었다.
3. 연구결과
3.1. 프로폴리스를 혼합한 리도카글액의 디스크확산법에 의한 항균 효과
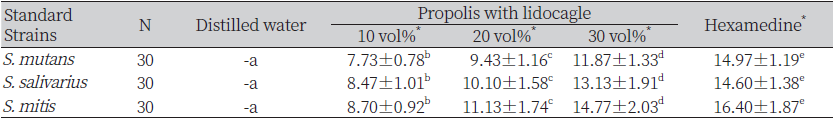
프로폴리스를 혼합한 리도카글액의 디스크확산법에 의한 평가로 S. mutans는 증류수에서는 나타나지 않았고 10 vol%에서 7.73±0.78 mm, 20 vol%에서 9.43±1.16 mm, 30vol% 에서 11.87±1.33 mm, 헥사메딘액에서 14.97±1.19 mm의 순으로 넓게 나타났다(p<0.05). S. salivarius 역시 증류수에서는 나타나지 않았고 10 vol%에서 8.47±1.01 mm, 20 vol%에서 10.10±1.58 mm, 30 vol%에서 13.13±1.91 mm, 헥사메딘액에서 14.60±1.38 mm의 순으로 넓게 나타났다(p<0.05). S. mitis에서도 증류수에서는 나타나지 않았고 10 vol%에서 8.7±0.92 mm, 20 vol%에서 11.13±1.74 mm, 30 vol%에서 14.77±2.03 mm, 헥사메딘액에서 16.4±1.87 mm의 순으로 넓게 나타났다(p<0.05)(Table 1, Figure 1).
3.2. 프로폴리스를 혼합한 리도카글액의 균 활성도 평가
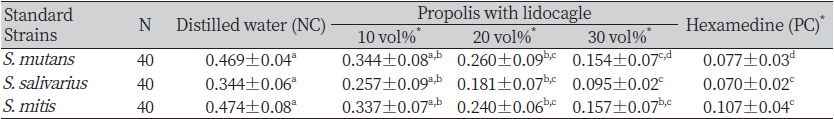
균 활성도 확인을 위하여 S. mutans, S. salivarius, S. mitis를 10 vol%, 20 vol%, 30 vol% 프로폴리스를 혼합한 리도카글액 및 헥사메딘액 0.12%의 균 생존율을 평가하였다(Table 2). O.D. 값으로 증류수 100%와 비교한 결과 10 vol% 에서는 유의성이 확인되지 않았고, 20 vol%와 30 vol%에서는 유의성이 확인되었다(p<0.05). 즉, S. mutans의 경우 증류수 O.D. 기준값은 0.469±0.04(100%) 였으며, 프로폴리스를 혼합한 리도카글액 20 vol%에서는 0.260±0.09, 30 vol%에서는 0.154±0.07, 헥사메딘액 0.12%에서는 0.077±0.03으로 나타났다(p<0.05). S. salivarius의 경우에서도 증류수 O.D. 값은 0.344±0.06(100%), 20 vol% 0.181±0.07, 30 vol% 0.095±0.02, 헥사메딘액 0.12%는 0.07±0.02로 나타났으며(p<0.05). S. mitis의 균 활성도는 역시 증류수 O.D. 값인 0.474±0.08(100%)를 기준으로, 20 vol%에서는 0.240±0.06, 30 vol%에서는 0.157±0.070, 헥사메딘액 0.12%에서는 0.107±0.04로 나타났다(p<0.05).
3.3. 프로폴리스를 혼합한 리도카글액의 균집락 형성평가
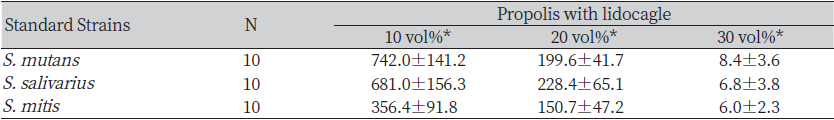
균집락 형성을 평가하기 위하여 프로폴리스를 혼합한 10 vol%, 20 vol%, 30 vol%의 CFU (Colony Forming Units)를 측정하였다(Table 3). S. mutans, S. salivarius, S. mitis 각각 10개의 plate에 대한 균집락 형성평가를 비교한 결과, S. mutans의 경우 10 vol%에서는 742±141.2, 20 vol%에서는 199.6±41.7, 30 vol%에서는 8.4±3.6으로 확인되었다(p<0.05). S. salivarius의 경우는 10 vol%에서는 681±156.3, 20 vol%에서는 228.4±65.1, 30 vol%에서는 6.8±3.8으로 나타났으며 S. mitis의 경우 10 vol%에서는 356.4±91.8, 20 vol%에서는 150.7±47.2, 30 vol%에서는 6±2.3으로 나타나 3종의 표준 세균 모두에서 프로폴리스의 농도가 높은 군에서 균집락 수가 높게 나타났다(p<0.05).
4. 고안
본 연구는 가글액의 임상적 활용 측면에서 프로폴리스를 혼합한 리도카글액이 치과치료에서 항균 효과뿐만 아니라 불편감 해소에도 도움이 될 수 있도록 가능성을 제시하고자 수행되었다. 본 연구 결과에서 디스크확산법과 균 활성도 평가 그리고 균집락 형성평가 모두 프로폴리스의 농도가 높은 리도카글액 항균 효과가 높아지는 것을 확인하였다. 그러나 프로폴리스를 혼합한 리도카글액이 S. mutans, S. salivarius, S. mitis에 대한 항균력을 유지하지는 못하였지만 대조군인 증류수(NC)나 10 vol%에 비하여 30 vol%에서는 넓은 inhibition zone과 낮은 균 활성도와 균집락 형성의 결과를 얻을 수 있었다.
선행연구에서 구강 내 세균 수를 줄이기 위한 프로폴리스의 항균효과는 그람 양성균인 Bacillus cereus, Bacillus subtilis, Listeria monocytogenes, Staphylococcus aureus, S. mutans와 그람 음성균인 C. freundii, E. aerogenesm E. coli, K. pneumoniae, S. enteritidis에서 항균효과의 유의성이 보고되었다(11). 또한 권 등의 연구에서도 프로폴리스는 Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitan, Fusobacterium nucleatum, Prevotella nigrescens, Tannerella forsythia에 대한 항균력을 보고한바 있고(12), 이 외에도 김 등의 연구에서도 프로폴리스는 S. aureus, S. mutans, Streptococcus sobrinus에 대한 항균력을 보고하였다(13). 본 연구의 결과에서는 S. mutans 외에 S. salivarius, S. mitis에 대한 프로폴리스를 혼합한 리도카글액의 항균 효과는 유의성이 확인되었다. 그러나 혼합 비율에서의 차이는 뚜렷하게 나타나 디스크확산법에서 역시 프로폴리스의 농도가 높을수록 더 높은 항균력을 나타냈는데(p<0.05), 그리하여 inhibition zone의 크기는 프로폴리스의 농도가 높아질수록 커지는 것을 확인할 수 있었다. Bruschi 등의 연구(14)에서와 같이 구강미생물 Enterococcus faecalis, Streptococcus salivarius, Streptococcus sangunis, S. mitis, S. mutans, S. sobrinus, Candida albicans, Lacticaseibacillus casei 8종을 대상으로 높은 비율의 프로폴리스를 함유한 젤라틴의 항균 효과가 S. salivarius, S. sanguinis, S. mitis and C. albicans에 대해 더 큰 활성을 보인 결과와 유사하였다. 다음으로 균 활성도 평가에서도 Negative Control인 증류수의 O.D. 값 100% 생존율을 기준으로 프로폴리스를 혼합한 리도카글액의 S. mutans, S. mitis, S. salivarius의 O.D. 값은 프로폴리스의 농도가 높을수록 더 높은 항균력을 나타냈고 증류수보다 높게 나타났다(p<0.05). Roh와 Kim(15)의 선행연구 결과에서도 의정부, 안산, 홍천, 익산, 광주, 상주 지역에서 채취한 프로폴리스의 항균효과를 비교하였을 때 모든 지역의 프로폴리스의 농도가 증가할수록 항균력이 높아진다는 결과 역시 본 연구의 내용과 유사하였다. 즉, 3종의 표준 세균 모두에서 프로폴리스의 농도가 높아질수록 균 활성도가 높아졌으며 모든 희석액에서 헥사메딘액 0.12% 보다는 낮은 균 할성도를 보였고 증류수보다는 높은 균 활성도를 보였다. 균집락 형성평가의 결과에서도 프로폴리스의 농도가 높아질수록 균집락 수가 감소하는 것을 확인하였는데(p<0.05), 유의 연구 결과에서도 유사하여 S. mutans를 배양하여 에탄올을 첨가한 배지의 경우는 균의 생육이 확인된 반면, 프로폴리스 첨가 배지의 경우는 균의 생육을 확인할 수 없다고 보고하였다(4).
일부 선행연구에서 스켈링 시 리도카인 2% 가글액과 20% 벤조카인이 함유된 국소마취 겔을 사용한 후 통증 경감과 불안감 해소에 효과가 있다고 보고하였고(1,16), 또 다른 연구에서도 전신적으로 후두 마스크 삽입 시 10% 리도카인을 분무하거나 자궁경 검사 시 5% 리도카인을 분무하였을 때 효과가 있었다는 보고(17)에서와 같이 리도카인 가글액의 통증 경감 효과에 프로폴리스의 항균 효과를 추가한다면 환자의 치과 치료 시 만족도를 향상시킬 수 있을 것으로 가능성을 제시할 수 있다.
그러나 본 연구에서 프로폴리스를 혼합한 리도카글액의 항균 효과는 프로폴리스의 농도가 높아질수록 높아지는 결과를 확인하였고, 클로르헥시딘에 비해 효과적이지 않았으나 증류수나 희석 비율을 고려하면 의미있는 결과를 얻은 것으로 생각한다. Ozan 등(18)의 연구 결과에서도 1%, 2.5%, 5%, 10% 농도의 프로폴리스 용액을 함유한 구강청결제는 0.2%의 클로르헥시딘이 함유된 구강청결제만큼 효과적이지는 않지만 치은섬유아세포에서는 세포독성이 덜하다고 보고하였다. 또 다른 선행연구인 김과 정의 연구(19)에서 프로폴리스의 구강 구취균에 대한 항균력 실험에서 프로폴리스의 농도가 항균 활성에 많은 영향을 미치므로 프로폴리스의 항균력은 농도 의존적임을 추측해 볼 수 있다고 하여(19) 본 연구의 시사점과 일치한다. Santiago 등(20)의 연구에 따르면 클로르헥시딘이 혼합되거나 없는 프로폴리스의 구강양치액을 14일 동안 사용한 집단은 클로르헥시딘만 사용한 집단과 유사한 PHP 지수를 보였다. 이 용액은 in vitro와 in vivo에서 S. mutans에 대한 항균 작용을 하여 치태 조절에 긍정적인 작용을 보였다(20). 즉, 본 연구의 결과와도 유사하게 프로폴리스에 다른 용액을 혼합하여도 구강세균에 대한 항균력은 부분적으로 유지됨을 확인할 수 있다.
이상의 연구 결과를 바탕으로 향후 프로폴리스와 리도카글액 혼합에 대한 임상적 적용 평가 및 세포독성 평가 등에 대한 추가적인 연구가 필요할 것으로 생각한다. 마지막으로 본 연구의 제한점으로는 리도카글액 혼합에 대한 통증 경감 효과까지는 확인하지 못하였으며 표준 세균의 최소성장억제농도에 대한 평가는 이루어지지 못하였다. 그러나 본 연구는 프로폴리스의 혼합 비율에 의한 리도카글액의 항균력을 확인하는데 의미가 있었으며 추후 치과 치료 전·후 항균 효과뿐만 아니라 불편감 경감을 기대할 수 있는 가글액으로의 사용 가능성을 제시하고자 한다.
5. 결론
본 연구는 구강점막 마취용액인 리도카글액에 천연 항균물질인 프로폴리스의 혼합 비율에 따라 S. mutans, S. mitis, S. salivarius에 대한 항균 효과를 알아보기 위하여 디스크확산법, 균 활성도 평가, 균집락 형성평가를 실시하여 평가하였다.
연구결과, 프로폴리스를 혼합한 리도카글액의 항균 효과는 모든 실험에서 리도카글액의 농도가 높고 프로폴리스의 농도가 낮아질수록 항균 효과는 낮아졌다. 그러나 낮은 프로폴리스 혼합 비율에서도 구강 내 세균에 대한 항균 능력은 확인되었으며 프로폴리스를 혼합한 리도카글액이 불편감을 경감시킬 수 있는 술 전 가글용액으로 사용 가능한 기초 자료를 제공하고자 한다.