서론
치과 의료 전문가들은 환자와의 대면 의사소통과 타액, 혈액 및 기타 체액에 대한 노출, 날카로운 기구의 취급으로 인해 다양한 형태의 감염에 노출된다. 치과 치료는 전염에 대한 우려로 이어지는 밀접한 환자 접촉을 포함하며, 환자와 작업 환경을 통해 박테리아, 바이러스 등을 포함한 다양한 미생물에 노출된다(1). 적절한 예방 조치가 없을 경우, 치과 의료 전문가는 공기를 매개로 한 다양한 전염병에 노출될 위험이 높다(2).
2019년 중국에서 처음으로 발생된 Coronavirus disease-19 (COVID-19)는 전 세계적으로 호흡기를 통해 전파되고 있다(3). COVID-19는 코로나바이러스에 의한 원인불명의 호흡곤란을 동반하는 감염성 질환으로 주된 전파경로는 감염자의 호흡기 비말이며(4) 급진적인 바이러스의 확산으로 호흡기와 관련된 비말 감염 및 전염병에 대해 관심이 더욱 높아졌다.
특히 치과 의료기관에서는 에어로졸이 생성되는 시술, 밀폐된 공간에서의 비말을 만드는 환경 등에 의해 전파되기 때문에 에어로졸 차단을 위한 마스크 착용 및 보호장비 착용의 중요성이 부각되고 있다(5). 또한 발병 이후 타액 속에 SARS-CoV–2 바이러스가 검출된다는 연구가(1) 밝혀지면서 환자들은 호흡기 감염에 대한 불안감이 초래하여 치과 내원율이 낮아졌음을 알 수 있다(6-9).
치과 진료에서 가장 사용빈도가 높은 초음파 스케일러 및 고속 핸드피스는 마찰열로 인한 치아손상 방지를 위해 냉각수를 이용하게 된다. 이 과정에서 고속 회전과 진동에 의해 다양한 미생물이 포함된 에어로졸은 여러 방면으로 확산된다(10). Micik RE et al(11)가 정의한 치과 에어로졸은 크기가 100 μ 미만이며 다양한 타액 및 혈액의 바이러스 및 미생물, 세균들이 포함되어 있다(12). 치과 에어로졸 속에는 S. epidermidis, Micrococcus, Diphtheroid, S. aureus, and Fungi 등 다양한 미생물을 포함하고 있으며(13-15) 이는 호흡기 및 비말로 깊게 침투할 수 있어 치과 의료 전문가 및 환자들에게 교차감염을 야기시킬 수 있다.
호흡기로 인한 감염과 치과 진료의 연관성에 대한 관심이 높아지고 있기 때문에 치과 의료 전문가들은 감염관리의 중요성을 더욱 인지하고, 에어로졸 내 미생물의 수를 줄이기 위한 다양한 선행 연구를 진행하고 있다. Narayana TV et al.(16)의 연구에서는 치과 에어로졸 속 박테리아 감소를 위해 High volume evacuator 및 구강 린스를 사용하여 미생물 수의 감소를 확인하였고, Mamajiwala AS et al.(17)의 연구는 치과 유닛 체어 용수에 클로르헥시딘 또는 계피 추출물을 넣어 치과 치료 시 미생물 수의 감소를 확인하기도 하였다.
이처럼 에어로졸에 관한 연구는 계속해서 진행되고 있지만 에어로졸 내 미생물과 오염 측정방법을 표준화하여 제시한 선행 연구는 아직 미흡하다. 치과 진료의 공기 중 교차감염에 관한 관심이 높아지는 만큼 앞으로 더 다양한 연구의 진행이 예상되며 이를 위한 미생물 측정 방법을 체계적으로 정리할 필요가 있다.
이 검토는 2000년 이후 국내외 치과에서 발생하는 치과 에어로졸과 교차감염과의 연관성을 기반으로 치과 내 부유하는 공기 속 에어로졸을 수집하여 다양한 종류의 오염을 측정하는 효과적인 연구 방법 확인을 위한 체계적 문헌 고찰이다. 따라서 에어로졸 속 오염을 측정하는 다양한 방법에 대한 기초적인 자료로 제공되고자 한다.
2. 연구 방법
2.1. 연구 설계
본 연구는 치과 에어로졸을 수집하여 오염 및 미생물을 측정하는 방법에 관한 체계적 문헌고찰이다. Cochrane에서 제시하는 Prisma guideline에 따라 Systematic review를 위한 프로토콜을 준수하고(18), RoBANS 서식의 지침에 따라 질 평가하였다(19).
2.2. 검색 전략
출판연도는 2000년 1월부터 2022년 8월 사이의 논문으로 제한하였다. 검색 데이터 베이스는 Google Scholar, PubMed, Cochrane Library를 이용하였다. Patient, Intervention, Comparison, Outcome-Study Design (PICO-SD) 형식에 따라 대상(P) 에어로졸 수집 대상, 비교군(C)은 에어로졸 수집 방법, 성과(O)는 오염 및 미생물 발견 여부로 구성하였으며, 사전연구 검색 및 Medical Subject Headings (MeSH) term을 이용하여 Key Word를 설정했다.
국내 데이터베이스는 (치과 에어로졸 OR 치과 미생물) AND (감염 OR 교차감염 OR 감염관리) AND (치과 치료 OR 치과 진료), 국외 데이터 베이스는 (Aerosols OR “Bio-aerosols” OR Splatter [MeSH]) AND (“Cross infection” OR Contamination [MeSH]) AND (“Dental care” OR “Dental procedure”[MeSH])로 검색하였다.
수집된 연구들은 서지 프로그램 Mendeley (Mendeley Ltd., Elsevier, Amsterdam, Netherlands)를 이용하여 관리하였다.
2.3. 자격 기준 및 연구 선택
본 연구는 에어로졸 미생물 측정 방법에 대한 고찰이므로 대상자에게 치과 치료를 시행하여 에어로졸을 수집한 연구들을 선택하였다.
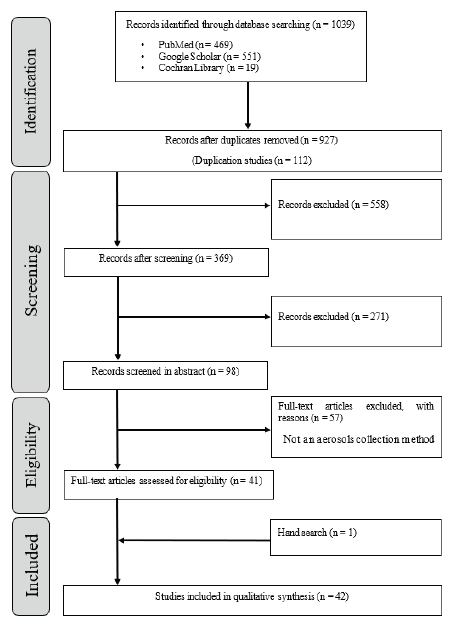
각 데이터베이스에서 총 1,039개의 논문이 수집되었으며 서지 프로그램 Mendely의 Duplicatse tool을 이용해 112개의 중복 논문이 제외되었다. 수집된 연구들은 2명의 연구자가 제목을 평가하여 1차로 558개의 논문들이 제외되었으며 2차로 초록을 읽어 271개의 논문들이 제외되었다. 선별된 98개의 논문들은 전문(Full text)을 읽어 최종적으로 41개의 논문이 선택되었으며 수동적으로 1개의 논문이 추가되어 총 42개의 논문이 최종 문헌 질 평가 대상으로 선택되었다(Figure 1).
2.4. 질 평가
2.4.1. 질 평가 방법
Kim SY et al.(19)이 제시한 Risk of Bias Assessment Tool for Nonrandomized Studies (RoBANS)를 이용하여 문헌 질 평가를 진행하였다. RoBANS 서식은 총 6개의 영역으로 질 평가를 할 수 있다. 그 항목은 다음과 같다. 참가자 선택 (Selection of participants), 교란 변수 (Confounding variables), 노출 측정 (Measurement of exposure), 결과 평가의 블라인딩 (the Blinding of the outcome assessments), 불완전한 결과 데이터 (Incomplete outcome data), 선택적 결과 보고 (Selective outcome reporting) 이다. 질 평가 등급은 해당 항목의 비뚤림 위험이 낮으면 (Low), 비뚤림 위험이 높으면 (High), 불확실한 경우(Unclear)로 총 3등급으로 평가하였다.
2.4.2. 질 평가 결과
최종 분석에 포함된 42개 논문들은 위 6개의 항목 중에서 주로 참가자 선택, 노출 측정 및 결과 평가의 블라인딩 항목에서 비뚤림 위험이 높거나 불확실했다. 참가자 선택 항목에서는 연구 참여자 선택 기준이 명시되어 있지 않거나, 각 그룹 간 구강 환경 중등도 차이를 알 수 없었다. 노출 측정 항목에서는 객관적인 미생물 측정 방법이 제시되지 않거나, 측정 도구 및 위치가 명시 되어있지 않았다. 결과 평가의 블라인딩 항목에서는 측정 평가자가 명시되어 있지 않거나, 눈가림 여부가 명시되어 있지 않았다.
2.5. 데이터 합성 및 통계 분석
선택된 42개의 연구는 두 명의 연구자가 전문을 모두 읽어 대상자의 일반적 특성(표본 수, 연령), 연구 참가자 선정 기준, 측정도구 및 방법, 수량화 된 치과 에어로졸 속 미생물 오염 발견 여부를 확인해 추출하였으며 제1저자명, 출판연도, 연구 설계를 조사하였다. 추출된 데이터는 표로 정리하여 비교, 분석하였다(Table 1, 2).
3. 연구 결과
42개의 논문 중 2000년부터 2009년까지의 논문은 총 6편, 2010년부터 2019년까지의 논문은 총 24편, 2020년부터 2022년 8월까지의 논문은 총 12편이었다.
3.1. 연구 대상
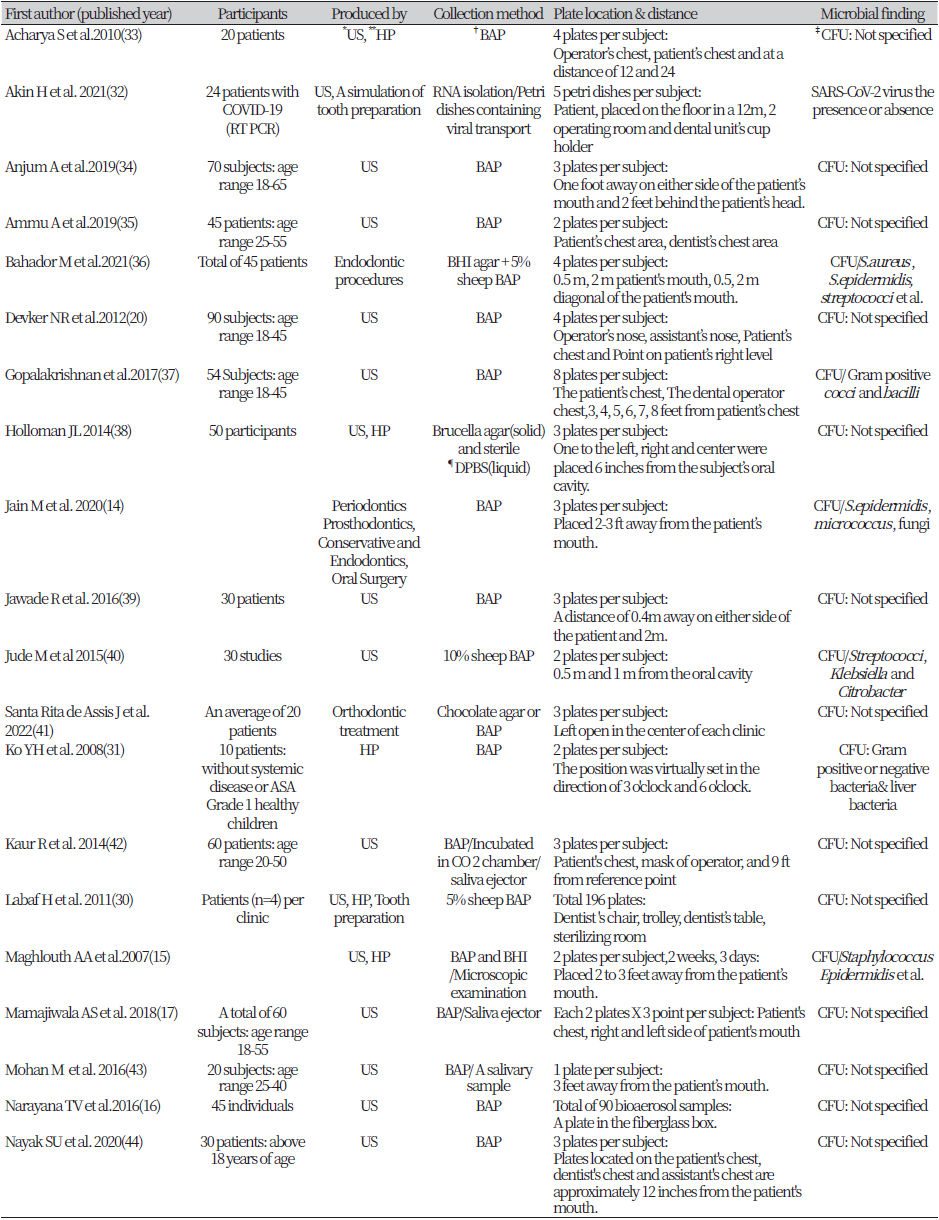
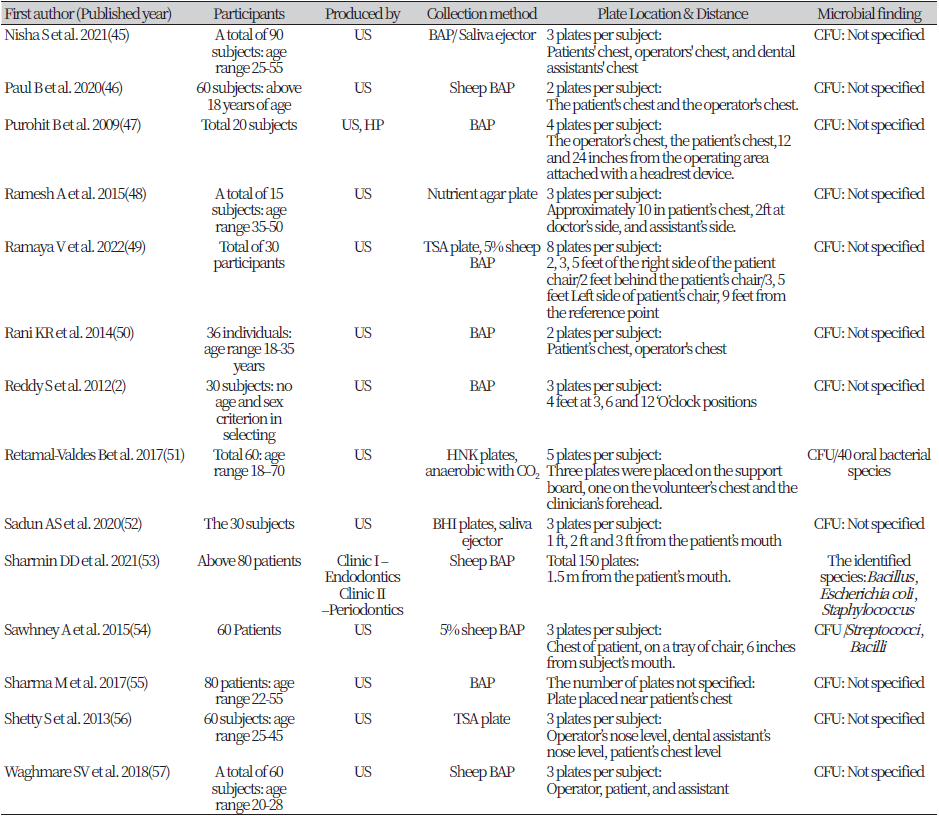
대상자가 명시되어 있지 않은 4개의 논문을 제외하고 모든 연구 참가자는 총 1,427명이었다. 42개의 연구 중 가장 많은 연구 참가자 표본은 Devker NR et al.(20)이 90명이었고 가장 적은 연구 대상자 표본은 Hallier C et al.(21)와 Kang KH et al.(22)이 8명으로 가장 적었다.
연구 참가자 선택 기준은 대체로 연령 및 구강 환경을 기준으로 선택하였다. 연령 범위는 논문마다 다르며 선정을 위한 최소 나이는 18세 이상부터 최대 나이는 70세까지의 범위를 두었다. 구강 환경은 42편 중 13편의 논문이 최소 20개 이상의 영구치 소유한 자를 선택하였다. 구강 환경 지수는 Gingival Index, Plaque Index, Clinical Attachment Loss, Probing Depth, Oral Hygiene Index-Simplified를 기준으로 선택하였고, 예외적으로 1편의 연구에서 ASA (Ameriacan Society of Anesthesiologists)Grade를 선정기준으로 선택하였다(31).
3.2. 치과 에어로졸 수집 방법
3.2.1. 직접 수집 방법
에어로졸 샘플 수집에 가장 많이 사용한 방법은 Johnston JR et al.(23)이 제시한 공기 중 박테리아를 혈액 한천판에 노출시켜 배양하는 방법이다. 각 사용한 배지마다 차이가 있지만 34개의 연구가 부유하는 공기 중 에어로졸을 배양판에 직접적으로 닿을 수 있게 노출시켜 수집하는 방식을 선택하였다.
사용된 배지로는 혈액 한천배지(5% 양-혈 한천배지, 10% 양-혈 한천배지, Chocolate 배지), BHI (Brain-Heart Infusion)배지, Brucellar (Solid)배지, Nutrient 배지, TSA (Trypticase Soy Agar)배지, HNK (Human Natural Killer)배지, R2A 배지가 있다. 이 중 혈액 한천배지의 비율이 약 72.42%로 가장 높았다.
42편의 연구 중 37편의 연구가 에어로졸이 수집된 배지를 37℃의 온도로 미생물 배양하였다. 이 중 22편의 연구가 48시간 동안 배양으로 가장 많은 비율을 차지했다. 그 외 24시간, 37시간, 72시간, 96시간 배양 순이었다. R2A agar는 23℃의 온도로 배양되었다(Table 1).
3.2.2. 공기 수집 장치 이용한 기계적 수집 방법
6편의 연구는 공기 수집 장치를 에어로졸을이용해 수집하는 방법이었다. Hallier C et al.(21)과 Zemouri C et al.(24)의 연구에 사용된 장치는 A Buck Bio-Culture™ (Model B30120, A. P. Buck, Orlando, USA) sampling pump로 수집 후 5% 양-혈 한천배지로 미생물 배양하였다. Son WK 등(25)의 연구에서는 M Air T sampler (M Air TTM, Millipore Corp., Massachusetts, USA)를 이용하여 에어로졸을 수집하고 TSA agar배지를 이용하여 미생물을 배양하였다. Park KE (26)의 연구에서는 미국의 Andersen사의 제품인 6-stage cascade air sampler (6-stage cascade air sampler, Andersen, USA)를 이용하였고 장치 내부에 TSA agar 배지를 배치 후 에어로졸을 수집하였다.
Toroglu MS et al.(27)의 연구에서는 고속 핸드피스 핸들 부분에 타액 이젝터를 달고, 이동식 흡입기를 연결하여 에어로졸만 수집하여 Occult Blood Test 하는 방법을 사용하였다. Greco PM et al.(28)의 연구에서는 투명 비닐 호흡마스크(CE 0086; Ace Surgical Supply, Brockton, USA)에 핸드피스가 수용될 수 있도록 포트홀을 만들고 산업용 공기 흡입 펌프(SKC Model 224-XR; SKC, Inc, Pa, USA)에 연결시켜 카세트에 수집된 에어로졸을 혈액 한천 배지에 미생물 배양하는 방법을 사용하였다(Table 2).
|
Table 2. Indirect & Other Collection Method of Dental Aerosols. 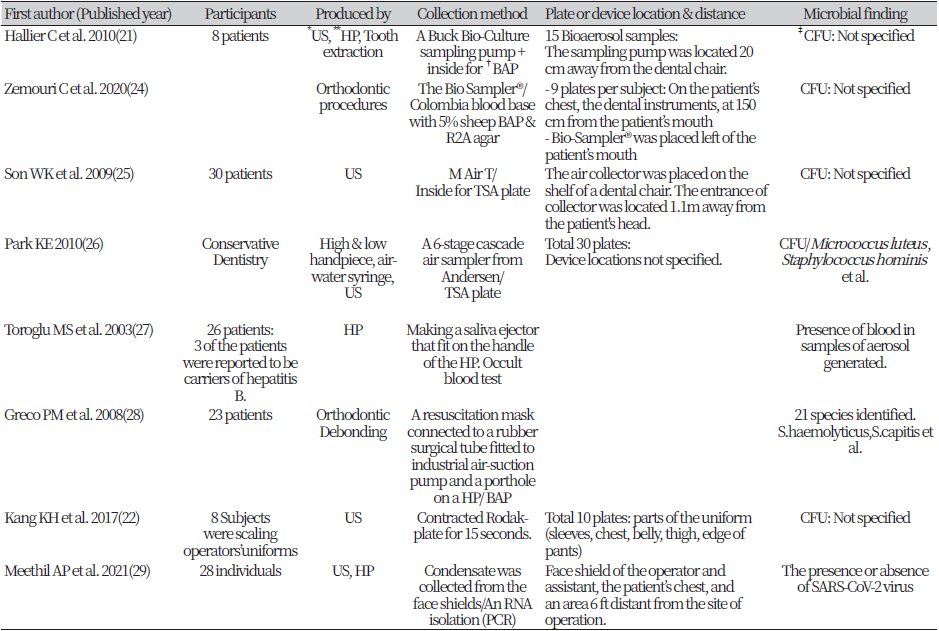
|
|
(*US: Ultrasonic Scaler, **BAP: Blood Agar Plate, †HP: High Speed Hand-piece, ‡CFU: Colony for Unit) |
3.2.3. 기타 수집 방법
Kang KH 등(22)의 연구는 에어로졸에 의한 의복 오염도를 확인하기 위해 플레이트를 의복에 15초간 직접 대고 배양하는 방법이 사용되었다. Meethil A.P et al.(29) 연구에서 술자가 사용한 Face shield에 모인 에어로졸 응축액을 모은 후 RNA Isolation을 하는 방법이 사용되었다(Table 2).
3.3. 에어로졸 수집을 위한 배지와 공기 수집 장치의 위치
42개의 연구 중 14개의 연구가 1번의 실험 마다 3개씩 plate를 배치하여 반복실험을 수행했다.
2개 배치 및 4개 배치가 각 5개의 연구에서, 5개 배치가 2개의 연구에서 수행되었다. 그 외 6개씩 8개, 9개, 10개의 배치가 각 1개의 연구에서 수행되었다.
5개의 연구는 연구에 사용된 전체 plate의 수를 15개, 30개, 90개, 150개, 196개로 명시하였다. 이 중 진료 부서 별 치과 에어로졸의 양을 조사한 Labaf H et al.(30) 연구가 196개로 가장 많은 plate를 사용하였다.
배지 위치의 기준점으로는 환자와 술자의 가슴이 약 40%로 가장 많은 비율을 차지하였다. 다음으로는 환자의 입 주변, 환자 및 술자의 코 주변, 환자의 양 옆 등이 있다.
공기 수집장치의 위치는 다음과 같다. Hallier C et al.(21)의 연구에 사용된 Buck bio sampler의 경우 치과 유니트 체어로부터 20 cm 떨어진 곳으로 위치했다. Zemouri C et al.(24) 연구에 사용된 Bio sampler는 환자의 입을 기준으로 왼쪽 50 cm 거리에 위치하였고, Son WK 등(25)의 연구에 사용된 M Air T sampler는 환자의 머리로부터 1.1 m 떨어진 곳에 위치했다. Park KE (26)의 연구에 사용된 6-stage cascade air sampler는 정확한 위치가 명시되어 있지 않았다(Table 2).
3.4. 수집된 에어로졸의 미생물
총 37편의 연구가 에어로졸 속 미생물의 수를 비교하였고, 그 중 10편의 연구만 배양 후 미생물 종류를 확인을 하였다. 명시된 미생물 종류에는 S. aureus, S. epidermidis, Streptococci, Bacillus, Escherichi a coil, S. haemolyticus, S. capitis, Micrococcus, Fungi, Klebsiella, Citrobacter, Micrococcus luteus, S. hominis 등 다양한 미생물을 확인할 수 있었다. 이 중 피부에 감염을 일으킬 수 있는 Streptococci(연쇄상구균), Bacillus(간균), S. epidermidis(표피포도상구균)가 가장 많은 비율로 발견되었다.
Ko YH 등(31)의 연구에서는 Gram-positive bacteria(73.9%), Gram-negative bacteria(12.9%), Gram negative liver bacteria(7.4%), Gram positive liver bacteria(5.8%)로 미생물 colony를 종류별로 구분하였다.
배양 조건이 명시되어 있는 연구 중 5편의 연구가 호기성(Aerobic)으로 배양되었고, 2편의 연구가 혐기성(Anaeribic)으로 배양하였다. 3편의 연구는 호기성과 혐기성 둘 다 배양하여 미생물을 확인하였다.
그 외 3편의 연구에서는 에어로졸 속 혈액 및 Virus 존재 여부를 확인하였다. Toroglu MS et al.(27)은 Occult Blood Test를 이용하여 혈액 속 Hepatitis virus의 존재 여부를 확인하였고, Meethil AP et al.(29), Akin et al.(32) 연구는 RNA isolation을 이용하여 SARS-CoV-2 virus의 존재 여부를 확인하였다(Table 2).
4. 고안
에어로졸은 입자가 작아 사람의 호흡기를 통해 감염으로 진행될 수 있다. 특히 치과에서의 공기 중 에어로졸에 의한 감염은 환자 및 치과 의료종사자에게 쉽게 노출되기 때문에 새로운 감염병의 등장과 함께 더욱 관심이 집중되고 있다. 2022 보건복지부에서 발표한 제2차 구강보건사업 기본계획(Oral Health Plan 2026)에 따르면 모든 국민이 감염 염려 없이 치과 서비스를 이용할 수 있도록 감염관리 정책 강화의 필요를 제시하고 있다(58).
2019년에 COVID-19 발병 이후 비말 및 공기전파를 통한 에어로졸 감염에 대한 선행 연구는 빠르게 진행되고 있으나 감염과 연관하여 에어로졸 수집 및 오염 측정 방법에 관한 표준 연구 방법은 제시되지 않았다. 따라서 본 연구는 현재까지 치과에서 발생하는 다양한 형태의 오염된 에어로졸 수집 방법을 체계적으로 정리 및 기초적 자료로 제시하고자 하는 목적으로 수행되었다.
수집된 문헌은 총 1,039건이었으며 두 명의 연구자가 문헌을 읽어 최종적으로 42개의 문헌이 수집되었다. 이 후 선별된 문헌들은 Cochrane 프로토콜 및 RoBANS 서식에 의해 질 평가하였다. 2020년 이후부터 2022년까지, 약 2 년간의 논문이 총 수집 범위의 28%를 차지한다. 이는 COVID-19 감염병 및 호흡기를 통한 감염 전파가 화두 되고 있는 만큼 치과 에어로졸과 감염에 대해 많은 연구가 빠르게 진행됨을 알 수 있다.
연구 결과 오염 측정을 위한 에어로졸 수집 방법은 생성된 에어로졸을 발생시켜 직접 배양 배지에서 수집하는 방법이 가장 많았고 공기 수집장치를 이용한 기계적 수집 방법 및 기타 다양한 방법들이 뒤를 이었다.
직접 수집방법을 사용한 연구들은 배지 플레이트를 열어 둔 채 최소 1분에서 최대 하루 동안 노출시간을 두었다. Ko YH 등(31)의 연구는 1 시간 동안 에어로졸을 수집하였다. 이 연구에 의하면 정상적 대기 중에 존재하는 그램 양성 및 음성 구균이 발견되었다. 또한 Park KE(26)의 연구에서는 하루 동안 진료 전, 진료 중으로 나누어 에어로졸을 수집하였는데 그 결과 진료 중이 더 높은 미생물 농도를 나타내었다. 이는 진료실 내 유동인구 증가로 인해 표본 채취에 영향을 미친 것으로 사료된다. Park CH 등(59)의 감시 배양검사 표준화 연구에 따르면 부유세균을 채취하는 동안 기침을 하거나 불필요한 동작을 하지 않도록 권장하고 있다. 이는 플레이트를 노출하는 시간 동안 치과 에어로졸뿐만 아니라 공기 중 섞여 있는 생활 세균이 측정결과에 오류를 줄 수 있음을 뒷받침하는 근거가 될 수 있다. 이러한 환경조건에 의해 생기는 측정오류를 방지하고자 발생된 에어로졸만 수집할 수 있는 장치를 고안하는 연구가 진행되고 있다 (27, 28). 직접적으로 치과 에어로졸을 수집하는 방법이 가장 빈번하게 사용되는 만큼 보다 정확한 에어로졸 수집 방법을 위해 더욱 더 새롭고 발전된 연구가 필요해 보인다.
수집된 치과 에어로졸을 배양하여 확인된 미생물은 Streptococci (연쇄상구균), Bacillus (간균), S. epidermidis (표피포도상구균) 가 가장 많은 비율로 발견되었다. 구균 계열은 조직에 감염을 일으킬 수 있는 균 종이며 면역력이 약한 사람에게는 치명적인 감염으로 이어질 수 있다(60-62). 또한, 연구 결과에서 에어로졸 내 SARS-Cov-2 virus의 존재 확인과 혈액 및 B형 간염 Virus를 확인할 수 있는데, 이러한 연구들을 바탕으로 치과 에어로졸은 바이러스 및 미생물을 포함하며 잠재적인 교차 감염의 위험이 될 수 있음을 근거로 제시할 수 있다.
본 연구는 최초로 진행된 치과 에어로졸 수집 방법에 관한 체계적 문헌고찰이다. 치과 에어로졸이라는 단어가 정의된 이후 그에 대한 활발한 연구가 진행되어 왔다. 하지만 그 양이 방대하기 때문에 한정된 범위를 두어 최근 약 20년간 치과 에어로졸에 관한 연구를 최대한 모아 다양한 결과를 도출하려 노력했다. 그럼에도 불구하고 에어로졸 수집 방법에 대한 기존 연구들을 취합하여 간접적인 연구 결과를 제시하고 있기에 결과에 다소 한계점을 가질 수 있다. 하지만 Cochran에서 제시한 Prisma guideline 및 RoBANS 서식에 따라 질적 평가를 하였고, 그 결과를 바탕으로 신뢰할 수 있는 연구 데이터가 수집되었다.
연구 결과를 취합하며 질적연구를 위한 데이터 외에도 양적인 데이터들이 수집되었다. 추후 본 연구를 이어 더 발전된 연구를 진행한다면 각 각의 데이터를 모아 체계적 문헌고찰 뿐 아니라 양적 연구인 메타 분석을 진행할 수 있을 것이다. 또한 언어적 차이로 인해 제외되었던 다양한 연구가 있기 때문에 결과 도출에 한계를 가지지만 세계 각 국의 언어를 번역하여 더 다양한 에어로졸 수집 방법을 찾을 수 있을 것으로 예상된다.
이에 본 연구는 추후 치과 에어로졸 내 미생물 연구에 관한 방법에 지침서로 기여할 것으로 사료된다. 또한 교차 감염에 있어 치과 에어로졸의 위험성을 뒷받침할 수 있는 근거가 될 수 있다.
5. 결론
본 연구는 치과 에어로졸 수집에 관련된 2000년 1월부터 2022년 8월까지의 문헌들을 수집하여 체계적 문헌고찰을 수행하였다. 총 1,039개의 논문 중 RoBANS 서식을 통한 질 평가를 하여 총 42개의 논문이 선정되었다. 선정된 논문들을 비교, 분석하여 다음과 같은 결론을 얻었다.
에어로졸 수집 및 미생물 측정 방법은 다음과 같은 방법으로 나눌 수 있다.
1. 42개의 논문 중 2000년부터 2009년까지의 논문은 총 6편, 2010년부터 2019년까지의 논문은 총 24편, 2020년부터 2022년까지의 논문은 총 12편이었다. 대상자가 정확하게 명시되어 있지 않은 4개의 논문을 제외하고 모든 연구 대상자는 총 1,427명이었다.
2. 에어로졸 수집 방법은 34개의 연구가 에어로졸 발생 후 부유세균을 배양배지에 수집하는 직접 수집 방법을 이용하였고 6개의 연구가 에어로졸 수집 장치를 이용 및 고안한 기계적 수집 방법, 그리고 2개의 연구가 의복 및 응축액을 이용한 기타 수집 방법으로 나뉜다.
3. 배양배지는 혈액 한천배지(72.4%)가 가장 많이 사용되었다. 1회 3개씩 배지를 사용하는 연구가 가장 많았고 배지 위치의 기준점으로는 환자와 술자 가슴 위치가 약 40%로 가장 많은 비율을 차지하였다.
4. 기타 에어로졸 오염 측정 연구는 Occult blood test를 통한 에어로졸 내 혈액 유무 확인 및 RNA Isolation을 이용한 에어로졸 속 SARS-CoV-2 Virus 유무 확인 등이 있다.
5. 확인 가능한 미생물 중 Streptococci (연쇄상구균), Bacillus (간균), S. epidermidis (표피포도상구균)이 가장 많은 비율로 발견되었다. 기타 연구는 에어로졸 속 혈액, SARS-Cov-2 virus를 발견하였다.
대체로 공기 중 부유하는 에어로졸의 특성을 이용하여 배양배지에 직접 수집하는 방법이 보편화 되어있다. 하지만 실험하는 환경 내에서도 발생할 수 있는 공기 부유세균이 포함되어 있을 가능성을 배제할 수 없기 때문에 더욱 정확한 수집 방법에 대해 정의할 필요가 있다. 향후 새로운 장치의 고안 뿐만 아니라 기존의 수집 방법의 신뢰성을 높일 수 있는 더 심화된 연구의 필요성을 제시한다.